Parler
- 1 year ago
- 0
- 0
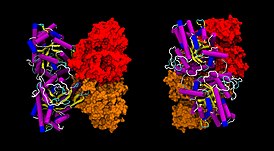
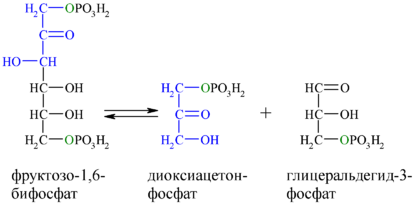
Альдолаза , также фруктозобисфосфат-(фруктозодифосфат)-альдолаза , реже альдолаза А — фермент ( КФ ) из семейства альдолазы (класс лиазы ), катализирующий реакцию негидролитического расщепления связей C-С (ретроальдольная конденсация) в молекуле фруктозо-1,6-дифосфата , в результате которой образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат в процессе гликолиза , а также обратную реакцию альдольной конденсации , происходящей в глюконеогенезе , по схеме:
Фермент играет важнейшую роль в энергетическом обмене.
У человека альдолаза А кодируется геном , который локализован на коротком плече (p-плече) 16-й хромосомы . У альдолазы имеется несколько изоферментов , помимо А это альдолаза B и С, которые отличаются локализацией экспрессии в тканях и органах и субстратной специфичностью. Альдолаза А экспрессируется в основном мышцах и эритроцитах , альдолаза B — в печени и почках , а альдолаза C — в гиппокампе и клетках Пуркинье головного мозга . Субстратная специфичность альдолазы В такова, что она примерно в одинаковом соотношении способна катализировать расщепление и конденсацию молекул, как фруктозо-1,6-бисфосфата , так и фруктозо-1-фосфата (до глицеральдегида и дигидроксиацетонфосфата ), в то же время альдолазы A и C, предпочитают первый субстрат (фруктозо-1,6-бисфосфат) . Такая субстратная специфичность альдолазы B обусловлена тем, что имеются небольшие различия в структуре фермента, а также она закодирована другим геном ( , 9-хромосома ). Альдолаза C закодирована геном , который расположен на длинном плече (q-плече) 17-й хромосомы .
Активность альдолазы в крови служит дополнительным диагностическим признаком ряда заболеваний. В ткани злокачественных опухолей фермент в несколько раз активнее, чем в не изменённых тканях, в эритроцитах активность фермента в 100 раз выше, чем в сыворотке крови , гемолиз существенно искажает результаты анализа . Генетически обусловленная неполноценность этого фермента является причиной наследственной непереносимости фруктозы . При ряде заболеваний ( , инфаркт миокарда , активный ревматизм , рак , поражения печени и др.) активность альдолазы в крови повышается, причем тем значительнее, чем тяжелее протекает болезнь .
В качестве унифицированного метода определения альдолазы в СССР принят , основанный на том, что продукты расщепления фруктозо-1,6-фосфата альдолазой при реакции с 2,4-динитрофенилгидразином образуют гидразоны , окрашенные в щелочной среде. Интенсивность окраски пропорциональна активности фермента.
В норме в сыворотке крови активность данного фермента составляет от 0,0038 до 0,02 (в среднем 0,012) мк моль фруктозо-1,6-дифосфата, превращённого ферментом, содержащимся в 1 мл сыворотки крови, за 1 мин при 37° .