Крепость Святой Елисаветы
- 1 year ago
- 0
- 0
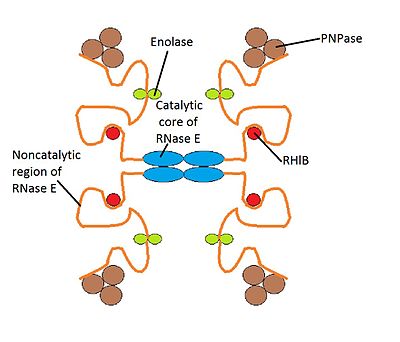
Деградосо́ма ( англ. degradosome ) — мультибелковый бактериальный комплекс, который участвует в процессинге рибосомальной РНК и деградации матричной РНК , регулируется некодирующими РНК . Он состоит из РНК - хеликазы B, рибонуклеазы Е (РНКазы Е), , а также гликолитического фермента енолазы . Деградосому можно изучать с помощью электронной микроскопии .
Пул РНК в клетке постоянно меняется. Например, у Escherichia coli срок жизни мРНК составляет от 2 до 25 минут, у других бактерий он может быть больше. Даже в клетках , находящихся в состоянии покоя, РНК постоянно разрушается, и свободные нуклеотиды , образовавшиеся при этом, в дальнейшем используются в синтезе нуклеиновых кислот . Кругооборот РНК чрезвычайно важен для регуляции экспрессии генов . мРНК бактерий крайне нестабильны по сравнению с мРНК эукариот . Это может быть связано с тем, что бактериям приходится быстрее репрограммировать свой пул мРНК (а следовательно, и белков ) в ответ на быстро меняющиеся условия окружающей среды .
В клетках всех организмов имеются специальные инструменты для деградации РНК, например, РНКазы, хеликазы, 3'-концевые , которые добавляют нуклеотидные хвосты к транскриптам , 5'- кэпирующие и декэпирующие ферменты, а также разнообразные . Часто перечисленные белки собираются в стабильные мультибелковые комплексы, в которых их активность скоординирована. У эукариот таким комплексом является экзосома , а у бактерий — деградосома.
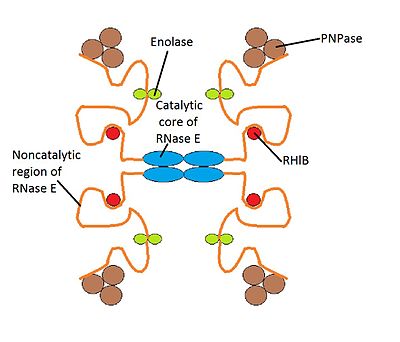
У E. coli масса деградосом составляет от 160 до 400 кДа , а константа седиментации — 8−16 S . Деградосома достаточно крупна, чтобы быть различимой в электронный микроскоп рядом с внутренней мембраной бактерии . Состав мультибелковой деградосомы может варьировать от организма к организму. У E. coli в состав деградосомы входят четыре основных компонента:
Возможно, в состав деградосом входит РНКаза III , расщепляющая двухцепочечные участки РНК . Также в состав деградосомы могут входить шапероны и .
С деградосомой тесно связана (хотя она и не входит в состав деградосомы). Этот фермент образует АТФ для работы хеликазы согласно уравнению (Ф) n + АДФ → (Ф) n−1 + АТФ .
Имеются различные варианты деградосом, содержащие разные белки. Дополнительными компонентами деградосомы могут быть PcnB ( ) и РНК-хеликазы RhlE и SrmB. В условиях в состав деградосомы может входить РНК-хеликаза CsdA. В стационарной фазе в состав деградосомы могут входить такие дополнительные компоненты, как РНКаза R (Rnr) и предполагаемая РНК-хеликаза HrpA. Кроме того, в число белков деградосомы может входить РНК-шаперон , (PAP), другие шапероны, а также .
Структура деградосомы E. coli в точности неизвестна, хотя существует модель её работы. Предполагается, что структура деградосомы нестабильна, и каждый её компонент взаимодействует с другими компонентами, находящимися в непосредственной его близости .
Деградосома — это большой мультиферментный комплекс, участвующий в метаболизме РНК и посттранскрипционной регуляции экспрессии генов у разнообразных бактерий, в числе которых Escherichia coli и . Он задействован в процессинге структурированных предшественников РНК в ходе их созревания .
Предполагается, что РНК-хеликаза играет вспомогательную роль в разрушении РНК, расплетая вторичные структуры РНК. Иногда вместе с деградосомами выделяется рРНК, подтверждая, что эти комплексы участвуют в деградации рРНК и мРНК. О роли деградосомы информации очень мало. При исследовании деградации транскриптов E. coli было показано, что первыми в ход вступают эндорибонуклеазы, которые надрезают РНК, с тем чтобы экзонуклеазы закончили разрушение получаемых фрагментов. РНК-хеликаза RhIB сама по себе малоактивна, но взаимодействие с РНКазой Е может усиливать её . Роль енолазы в процессе разрушения РНК пока непонятна, но, возможно, она увеличивает специфичность комплекса . Известно, однако, что енолаза в составе деградосомы необходима для быстрого разрушения мРНК глюкозного транспортёра в ответ на фосфосахарный стресс у E. coli .
Активация деградосомы происходит под действием некодирующих РНК, соответствующих микроРНК эукариот. Существует два пути для направления РНК на разрушение: связывание с участком инициации трансляции или с . Для связывания некодирующей РНК с мРНК-мишенью необходим шаперон Hfq. Прикрепившийся комплекс Hfq и некодирующей РНК не даёт рибосоме связаться с транскриптом и активирует нуклеазы (РНКазу Е) для его разрушения. При связывании с кодирующей последовательностью комплекс не даёт рибосоме двигаться дальше, запуская процесс разрушения .
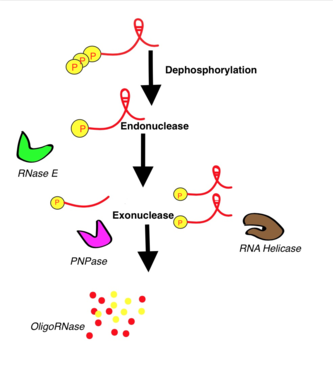
Процесс разрушения РНК очень сложен. В качестве примера рассмотрим наиболее изученное разрушение — мРНК деградосомой Escherichia coli . В разрушении мРНК участвуют как эндо-, так и экзонуклеазы. Фермены и полинуклеотидфосфорилаза (ПНФаза) разрушают мРНК в направлении 3' → 5'. В деградосоме можно выделить 4 компартмента, содержащие несколько РНКаз. С самого начала новосинтезированная мРНК содержит полифосфат . Поэтому первой стадией разрушения мРНК является с образованием монофосфата под действием РНК-пирофосфогидролазы. В транскрипте, помимо фосфатного конца (Р-конца), имеется концевая шпилька . Р-конец разрезается эндорибонуклеазой РНКазой Е, а шпилька устраняется РНК-хеликазами. Если в транскрипте имеются дополнительные вторичные структуры, то для упрощения работы экзорибонуклеаз (например, ПНФазы) необходимо действие полимеразы РАР. Наконец, отдельные фрагменты расщепляются олигорибонуклеазами. У других микроорганизмов процесс происходит схожим образом, хотя ферментный состав комплекса может отличаться. Например, у Bacillus subtilis в качестве эндорибонуклеазы вместо РНКазы Е используются РНКазы Y или J, а у архей РНК разрушается экзосомами .
Хотя структура деградосомы динамична, её состав вариабелен, а в некоторых лабораторных условиях деградосома и вовсе не нужна, она, тем не менее, сохранилась в ходе эволюции , возможно, из-за того, что она участвует во многих процессах, регулирующих экспрессию генов. Экспериментально было продемонстрировано, что у E. coli наличие экзосомы является селективным преимуществом. Гомологи белков деградосомы E. coli прослеживаются во всех доменах жизни . Стоит, однако, отметить, что у E. coli процесс разрушения РНК не может идти в направлении 5' → 3'. На 5'-конце мРНК E. coli нет кэпа, а экзонуклеазы, работающие в направлении 5' → 3', неизвестны. Похожая ситуация имеет место и у других бактерий, поэтому разрушение транскриптов 5' → 3' может быть уникальной чертой эукариотических клеток .