Ферментативная кинетика
- 1 year ago
- 0
- 0

Химическая кинетика или кинетика химических реакций — раздел физической химии , изучающий закономерности протекания химических реакций во времени , зависимости этих закономерностей от внешних условий, а также механизмы химических превращений .
Предметом химической кинетики является изучение всех факторов, влияющих на скорость как суммарного процесса, так и всех промежуточных стадий.
Гомогенная реакция — реакция , в которой реагирующие вещества находятся в одной фазе.
Гетерогенная реакция — реакция, происходящая на границах раздела фаз — между газообразным веществом и раствором , между раствором и твёрдым веществом, между твёрдым и газообразным веществами.
Реакция называется простой, если продукт образуется в результате непосредственного взаимодействия молекул (частиц) реагентов .
Реакция называется сложной, если конечный продукт получается в результате осуществления двух и более простых реакций (элементарных актов) с образованием промежуточных продуктов .
Важным понятием химической кинетики является
скорость химической реакции
. Эта величина определяет, как изменяется
концентрация
компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например, для реакции скорость можно выразить так:
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс , согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени . Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора , температура ( правило Вант-Гоффа ) и площадь поверхности раздела фаз .
Экспериментальные методы химической кинетики подразделяются на химические , физические , биохимические в зависимости от способа измерения количества вещества или его концентрации в ходе реакции.
К химическим относятся методы кинетики, основанные на традиционных способах количественного химического анализа — титриметрических , гравиметрических и др.
В современной экспериментальной кинетике к числу наиболее широко применяемых физических методов относятся различные спектральные методы. Эти методы основаны на измерениях, как правило спектров поглощения реагентов или продуктов в ультрафиолетовой , видимой и инфракрасной областях . Широко используют также спектры электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР) [ страница не указана 1541 день ] .
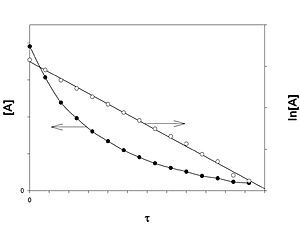
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции .
Кинетическое уравнение имеет следующий вид:
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
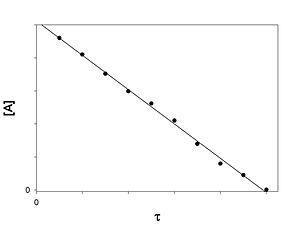
Кинетическое уравнение реакции первого порядка:
Приведение уравнения к линейному виду даёт уравнение:
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
Период полупревращения:
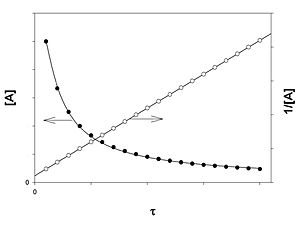
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
или
В первом случае скорость реакции определяется уравнением:
Линейная форма уравнения:
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
Во втором случае выражение для константы скорости реакции будет выглядеть так:
Период полупревращения (для случая равных начальных концентраций!):
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы ( изомеризация , диссоциация и т. д.):
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трёх частиц:
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определённой взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
Одновременное столкновение более трёх молекул практически невозможно. Большие стехиометрические коэффициенты в уравнении реакции (сумма коэффициентов более 3) указывают на сложный механизм реакции.
|
|
Эта статья или раздел нуждается в переработке.
|
Катализ — процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Каталитические реакции — реакции, протекающие в присутствии катализаторов .
Положительным называют катализ, при котором скорость реакции возрастает, отрицательным ( ингибированием ) — при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты . Примером отрицательного — снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл , нитрит натрия , хромат и дихромат калия .
Многие важнейшие химические производства, такие, как получение серной кислоты , аммиака , азотной кислоты , синтетического каучука , ряда полимеров и др., проводятся в присутствии катализаторов.
|
|
Эта статья или раздел нуждается в переработке.
|
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира . Многие жизненно важные химические реакции, протекающие в клетке (что-то около десяти тысяч), управляются особыми органическими катализаторами, именуемыми ферментами или энзимами . Термину «особый» не следует уделять пристального внимания, так как уже известно, из чего построены эти ферменты. Природа избрала для этого один-единственный строительный материал — аминокислоты и соединила их в полипептидные цепи различной длины и в разной последовательности.
Это так называемая первичная структура фермента, где R — боковые остатки, или важнейшие функциональные группы белков , возможно, выступающие в качестве активных центров ферментов. На эти боковые группы и ложится основная нагрузка при работе фермента, пептидная же цепь играет роль опорного скелета. Согласно структурной модели Полинга — Кори, она свернута в спираль, которая в обычном состоянии стабилизирована водородными связями между кислотными и основными центрами:
Для некоторых ферментов установлены полный аминокислотный состав и последовательность расположения их в цепи, а также сложная пространственная структура. Но это всё же очень часто не может помочь нам ответить на два главных вопроса:
Строгая избирательность и высокая скорость — два основных признака ферментативного катализа, отличающие его от лабораторного и производственного катализа. Ни один из созданных руками человека катализаторов (за исключением, пожалуй, 2-оксипиридина) не может сравниться с ферментами по силе и избирательности воздействия на органические молекулы.
Активность фермента, как и любого другого катализатора, тоже зависит от температуры: с повышением температуры возрастает и скорость ферментативной реакции. При этом обращает на себя внимание резкое снижение энергии активации Е по сравнению с некаталитической реакцией. Правда, это происходит не всегда. Известно много случаев, когда скорость возрастает благодаря увеличению не зависящего от температуры предэкспоненциального множителя в уравнении Аррениуса .
Константа химического равновесия