Гидрокси́д ба́рия
(
е́дкий бари́т
или
ба́риевая щё́лочь
,
химическая формула
—
Ba(OH)
2
) —
химическое
неорганическое соединение
, проявляющее сильные
основные свойства
. Насыщенный водный раствор гидроксида бария называется «
бари́товой водо́й
».
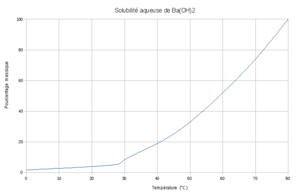
Растворимость гидроксида бария
Физические свойства
Гидроксид бария при
стандартных условиях
представляет собой бесцветные
кристаллы
.
Гигроскопичен
. Не растворим в
спирте
, но растворим в
воде
. Образует
кристаллогидраты
с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен,
ПДК
составляет 0,5 мг/м
3
.
Получение
1. Взаимодействие
металлического
бария
с
водой
:
B
a
+
2
H
2
O
⟶
B
a
(
O
H
)
2
+
H
2
↑
{\displaystyle {\mathsf {Ba+2H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}\uparrow }}}
2. Взаимодействие
оксида бария
с
водой
:
B
a
O
+
H
2
O
⟶
B
a
(
O
H
)
2
{\displaystyle {\mathsf {BaO+\ H_{2}O\longrightarrow \ Ba(OH)_{2}}}}
3. Взаимодействие
сульфида бария
с горячей
водой
:
B
a
S
+
2
H
2
O
⟶
B
a
(
O
H
)
2
+
H
2
S
↑
{\displaystyle {\mathsf {BaS+2H_{2}O\longrightarrow \ Ba(OH)_{2}+\ H_{2}S\uparrow }}}
Химические свойства
1. Взаимодействие с
кислотами
с образованием
соли
и
воды
(
реакция нейтрализации
):
B
a
(
O
H
)
2
+
2
H
B
r
⟶
B
a
B
r
2
+
2
H
2
O
{\displaystyle {\mathsf {Ba(OH)_{2}+2HBr\longrightarrow \ BaBr_{2}+2H_{2}O}}}
B
a
(
O
H
)
2
+
H
2
S
O
4
⟶
B
a
S
O
4
↓
+
2
H
2
O
{\displaystyle {\mathsf {Ba(OH)_{2}+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +2H_{2}O}}}
2. Взаимодействие с
кислотными оксидами
с образованием
соли
и
воды
:
B
a
(
O
H
)
2
+
C
O
2
⟶
B
a
C
O
3
↓
+
H
2
O
{\displaystyle {\mathsf {Ba(OH)_{2}+\ CO_{2}\longrightarrow \ BaCO_{3}\downarrow +\ H_{2}O}}}
B
a
(
O
H
)
2
+
S
O
3
⟶
B
a
S
O
4
↓
+
H
2
O
{\displaystyle {\mathsf {Ba(OH)_{2}+\ SO_{3}\longrightarrow \ BaSO_{4}\downarrow +\ H_{2}O}}}
3. Взаимодействие с
амфотерными оксидами
:
B
a
(
O
H
)
2
+
Z
n
O
+
H
2
O
⟶
B
a
[
Z
n
(
O
H
)
4
]
+
H
2
O
{\displaystyle {\mathsf {Ba(OH)_{2}+\ ZnO+\ H_{2}O\longrightarrow \ Ba[Zn(OH)_{4}]+\ H_{2}O}}}
4. Взаимодействие с
солями
:
B
a
(
O
H
)
2
+
K
2
S
i
O
3
⟶
2
K
O
H
+
B
a
S
i
O
3
↓
{\displaystyle {\mathsf {Ba(OH)_{2}+\ K_{2}SiO_{3}\longrightarrow \ 2KOH+\ BaSiO_{3}\downarrow }}}
Применение
Гидроксид бария применяют в виде баритовой воды как реактив на SO
4
2−
и CO
3
2−
(
сульфат-
и
карбонат
-ионы), для очистки растительных
масел
и животных
жиров
, как компонент смазок, для удаления SO
4
2−
(
сульфат
-ионов) из промышленных
растворов
, получения солей
бария
, а также
гидроксидов рубидия
и
цезия
из их
сульфатов
и
карбонатов
.
Примечания
Литература
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. —
М.
: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.