Interested Article - Нитрат аммония
- 2020-09-29
- 1
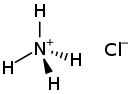
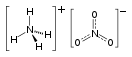
Нитра́т аммо́ния (аммонийная (аммиачная) селитра ) — химическое соединение NH 4 NO 3 , соль азотной кислоты . Впервые получена Иоганном Глаубером в 1659 году . Используется в качестве компонента взрывчатых веществ и как азотное удобрение .
Физические свойства

Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е. м. Скорость детонации 2570 м / с .
Растворимость
Растворимость в воде :
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия ), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке , пиридине , метаноле , этаноле .
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота :
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак , часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
- при давлении, высокой температуре и катализаторе
- .
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
-
Природный фосфат кальция (
апатит
) растворяют в азотной кислоте:
- .
- Полученную смесь охлаждают до 0 °C, при этом нитрат кальция кристаллизуется в виде тетрагидрата — Ca(NO 3 ) 2 ·4H 2 O, и его отделяют от фосфорной кислоты.
-
На полученный
нитрат кальция
, не очищенный от
фосфорной кислоты,
действуют
аммиаком
, получая в итоге нитрат аммония:
- .
Химические свойства
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
-
Температура ниже 200 °C:
- + 36,8 кДж/моль.
-
Температура выше 350 °C или детонация:
- + 112,6 кДж/моль.
В этих двух процессах выделяется не только большое количество тепла, но и сильный окислитель, поэтому в качестве взрывчатых веществ используются смеси нитрата аммония с восстановителем, например - с алюминиевой пудрой ( аммонал ).
Также нитрат аммония реагирует с щелочами (для данной реакции характерно выделение аммиака):
-
- .
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Модификация | Диапазон температур (°C) | Тип симметрии | Изменение объёма (%) |
|---|---|---|---|
| расплав | > 169.4 (безводный) | отсутствует | |
| I | 169.6 — 125.2 | кубическая | −2.13 |
| II | 125.5 — 84.2 | тетрагональная | −1.33 |
| III | 84.2 — 32.3 |
α-ромбическая
(моноклинная) |
+0.8 |
| IV | 32.3 — −16.8 |
β-ромбическая
(бипирамидальная) |
−3.3 |
| V | −50 — −16.8 | тетрагональная | +1.65 |
| VI | существует при высоких давлениях | ||
| VII | 170 | ||
| VIII | существует при высоких давлениях | ||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва .
Применение
Удобрения

Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение , либо как полупродукт для получения прочих удобрений. Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел ( карбонат кальция ).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США .
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
- составы типа аммиачная селитра/ дизельное топливо ( АСДТ )
- жидкая смесь аммиачная селитра/ гидразин ( Астролит )
- водонаполненные промышленные взрывчатые вещества ( Акванал , и др.)
- смеси с другими взрывчатыми веществами ( Аммонит , Детонит и др.)
- смесь с алюминиевой пудрой ( аммонал )
В чистом виде аммиачная селитра значительно уступает большинству взрывчатых веществ по энергии взрыва, однако её взрывоопасность должна учитываться при транспортировке и хранении. Взрывоопасность гранулированной селитры повышается с ростом её влажности и при температурных перепадах, приводящих к перекристаллизации .
Безопасный состав
В 2013 г. сотрудники Sandia National Laboratories объявили о разработке безопасного и эффективного состава на основе смеси нитрата аммония с сульфатом железа , который не может быть использован для создания на его основе взрывчатых веществ. При разложении состава ион SO 4 2− связывается с ионом аммония, а ион железа — с нитрат-ионом, что предотвращает взрыв. Введение в состав удобрения сульфата железа может улучшить и технологические характеристики удобрения, особенно на закисленных почвах. Авторы отказались от защиты формулы удобрения патентом с тем, чтобы этот состав мог получить быстрое распространение в регионах с высокой террористической опасностью .
Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.
См. также
Примечания
- (англ.) / — 97 — Boca Raton: 2016. — P. 5—4. — ISBN 978-1-4987-5428-6
- Дубнов Л. В., Бахаревич Н. С., Романов А. И. . — 3-е изд., перераб. и доп. — М. : Недра, 1988. — С. —228. — 358 с. — ISBN 5-247-00285-7 .
- (англ.) . Associated Press (2 августа 2011). Дата обращения: 30 сентября 2013. 1 января 2015 года.
- / под общ. ред. Е. Я. Мельникова . — 2-е изд., перераб.. — М. : Химия, 1987. — С. 157, 159. — 464 с.
- (News release) . Sandia Labs News Releases . 2013-04-23. из оригинала 6 сентября 2015 . Дата обращения: 30 сентября 2013 .
Литература
- Технология аммиачной селитры , под ред. В. М. Олевского, М., 1978.
- Соли азотной кислоты , Миниович М. А., М., 1964.
- Олевский В. М., Ферд М. Л., « Ж. Всес. хим. о-ва им. Д. И. Менделеева », 1983, т. 28, № 4, с. 27—39.
- Дубнов Л. В., Бахаревич Н. С., Романов А. И. Промышленные взрывчатые вещества. — 3-е изд., перераб. и доп. — М.: Недра, 1988. — 358 с.
- ГОСТ 2—2013 Селитра аммиачная. Технические условия . Стандартинформ, 2014
Ссылки
- от 17 января 2008 на Wayback Machine
- 2020-09-29
- 1