Interested Article - Пневматическая химия
- 2021-12-12
- 1
Пневматическая химия (пневматология) (от греч. πνεῦμα — дыхание, дуновение, дух) — название химии газов , применявшееся в конце XVIII — начале XIX вв. В настоящее время используется исключительно как исторический термин, характеризующий ранний период химического исследования газов.
Становление
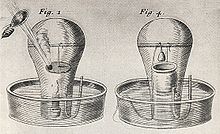
До середины XVII века газы ещё не различались и считались лишь разными видами воздуха. Фламандский химик Ян Ван-Гельмонт , по-видимому, первый показал, что следует признать существование ряда различных воздухообразных тел, которые он назвал газами (франц. gaz , от греч. chaos — хаос ). Он положил основание пневматической химии своими наблюдениями над образованием непохожего на воздух « лесного газа » ( gas sylvestre ) при действии кислот на известняк , при брожении молодого вина, при горении угля.
После Ван-Гельмонта изучением газов занимались отдельные исследователи. Жан Рэ ещё в 1630 году предположил участие воздуха при обжиге металлов . Роберт Бойль , основоположник экспериментального подхода к определению элементов, сконструировал один из первых воздушных насосов и открыл с его помощью в 1660 году газовый закон , носящий теперь его имя. В 1665 году Роберт Гук в работе «Микрография» также предположил наличие в воздухе особого вещества, подобного веществу, содержащемуся в связанном состоянии в селитре . Дальнейшее развитие эти взгляды получили в книге «О селитре и воздушном спирте селитры», написанной в 1669 году английским химиком Джоном Мейоу . Мейоу, проведя знаменитые опыты с горящей свечой под колоколом, пытался доказать, что в воздухе содержится особый газ ( spiritus nitroaëreus ), поддерживающий горение и необходимый для дыхания.
Формирование во второй половине XVII века флогистонной теории — первой научной теории химии — послужило мощным стимулом развития количественных исследований, без которых было невозможно экспериментальное подтверждение гипотезы о химических элементах . Важным следствием появления флогистонной теории явилось активное изучение химиками газов вообще и газообразных продуктов горения в частности. Факт того, что воздух легко сжимается, стал несомненным доводом в пользу возрождения атомистических представлений и уже первые эксперименты с газообразными веществами привели к гипотезе о дискретном ( корпускулярном , от лат. corpuscula — частица) строении вещества.
В начале XVIII в. химики не проявляли особого интереса к изучению газов. Основной причиной этого было отсутствие в их распоряжении удобных методов получения, собирания и исследования свойств отдельных газов. Однако некоторые ученые все же пытались исследовать свойства известных в то время газов, применяя воздушный насос Бойля и примитивные приспособления для собирания выделяющихся в различных процессах газов. Так, Михаил Ломоносов , изучавший механизм растворения металлов в кислотах , получил при растворении меди в азотной кислоте оксиды азота и описал некоторые свойства этого газа. Для собирания газа он пользовался бычьим пузырем.
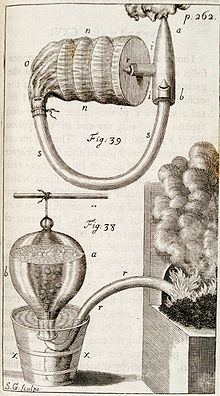
Важный шаг в начале XVIII века по преодолению экспериментальных затруднений был сделан английским химиком Стивеном Гейлсом , который изобрёл « пневматическую ванну » — прибор для улавливания газов, выделяющихся при разложении веществ, который представлял собой сосуд с водой, погруженный вверх дном в ванну с водой. Тем самым исследователи получили важнейший инструмент для выделения, идентификации и изучения различных летучих веществ.
Открытие и исследования газов во второй половине XVIII века
Начало пневматической химии было положено работами английского учёного Джозефа Блэка . Блэк установил (1756), что при нагревании белой магнезии из неё выделяется газ и образуется с потерей массы жжёная магнезия . На основе этих опытов Блэк сделал вывод, что в состав мягких щелочей ( углекислых солей ) входит некий « связанный воздух », позже названный углекислым газом . Блэк открыл также реакцию поглощения углекислого газа « известковой водой ». Отсюда возникло представление, что благодаря определённым воздействиям можно выделить отдельные газы из их смесей. Этот опыт явился важнейшей предпосылкой для возникновения газового анализа . Кроме того, Блэк обнаружил возможность определения массы газообразных веществ при рассмотрении их соединений, находящихся в твердом состоянии.
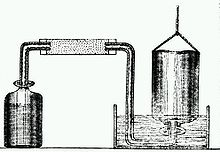
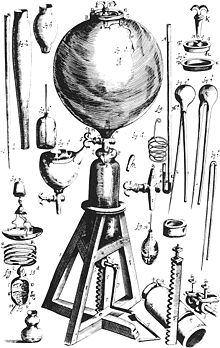
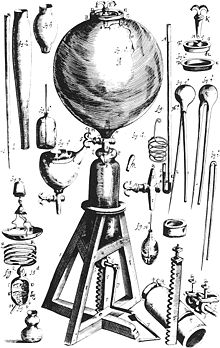
Открытие способов получения минеральных кислот (прежде всего, серной и соляной ) в XVII веке положило начало наблюдениям за выделением некоего «воздуха» при действии кислот на железо и другие металлы. Исследователем впервые описавшем природу этого газа стал английский ученый Генри Кавендиш . В 1766 году Кавендиш опубликовал работу «Искусственный воздух», где сообщалось об открытии «горючего воздуха» ( водорода ), а также описывались методики собирания, очистки и изучения газов. Кавендишу удалось получить в чистом виде водород и углекислый газ, установить их относительную плотность и другие свойства.
В 1781 году Кавендиш определил состав воздуха, а в 1784 г., сжигая водород, установил качественный состав воды, опровергнув представления об её элементарности (неразложимости на более простые вещества). В своих исследованиях Кавендиш применил новый метод — действие электрического разряда на смеси газов в изолированных от воздуха стеклянных сосудах. Именно так Кавендиш впервые получил воду из смеси водорода и кислорода. В 1785 году Кавендиш обратил внимание на пузырьки «остаточного воздуха» (1/120 первоначального объёма), который не изменялся под действием электричества (лишь в 1894 году лорд Рэлей установил, что «остаточный воздух» — это инертный газ аргон ). Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лавуазье . Он же впервые получил его из воды и дал этому веществу название Hydrogenium (водород).

Больших успехов в выделении газов и изучении их свойств достиг протестантский священник Джозеф Пристли . Близ Лидса , где он служил, находился пивоваренный завод, откуда можно было получать в больших количествах «связанный воздух» для проведения опытов. Пристли обнаружил, что газы могут растворяться в воде, и предложил собирать их не над водой, а над ртутью. Так он сумел собрать и изучить « веселящий газ », аммиак , хлороводород , диоксид серы . В 1774 году Пристли сделал самое важное своё открытие — кислород : нагревая красный оксид ртути , он выделил газ, в котором вещества горели особенно ярко. Будучи сторонником теории флогистона , он назвал этот газ «дефлогистированным воздухом». Газ, открытый Пристли, казался антиподом химически инертного «флогистированного воздуха» ( азота ), выделенного в 1772 году английским химиком Даниэлем Резерфордом .
Из большей силы и яркости пламени свечи в этом чистом воздухе можно заключить, что он (полученный Пристли газ) может быть особенно полезен для лёгких в некоторых болезненных случаях. Я имел возможность испытать его эффект на себе, вдыхая значительное количество его через трубку. Это дало мне замечательное ощущение свободы и лёгкости в груди. Кто бы мог отрицать, что когда-нибудь этот чистый воздух станет модным средством для развлечений? До сих пор, однако, только две мыши и я сам имели привилегию дышать им.
Я не могу не польстить сам себе, что, в своё время применение этих разнообразных видов газов станет широко использоваться в медицине— Пер. по
Следует отметить, что свойства газа, выделенного Пристли, ещё в 1771 году описал шведский химик Карл Вильгельм Шееле , получивший его разложением селитры , но его сообщение по небрежности издателя появилось в печати лишь в 1777. Шееле назвал этот газ «огненным воздухом» и сообщил о своём опыте Лавуазье. Шееле использовал для улавливания газов дыхательные пузыри крупных рыб. Лишь необычайные способности Шееле как экспериментатора позволили ему с помощью этой примитивной техники совершить также такие выдающиеся открытия, как обнаружение хлора (1774) и сероводорода (1776).
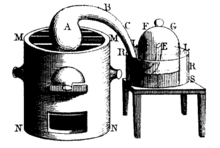
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена , который опубликовал работы по окислению ртути и последующему разложению её оксида (1784).
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Прибегая в своих исследованиях постоянно к точному взвешиванию, Лавуазье показал, что при процессе горения вещество не выделяется из горящего тела, а присоединяется к нему. Установив свой новый взгляд на процессы горения и окисления (работы 1775—1789 гг.), Лавуазье вместе с тем правильно понял состав воздуха. Путём анализа и синтеза он показал, что воздух есть смесь двух газов: один из них — есть газ, преимущественно поддерживающий горение, «здоровый ( salubre ) воздух, чистый воздух, жизненный воздух, кислород», как последовательно называл его сам Лавуазье, другой газ — нездоровый воздух ( moffette ), или азот. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье также предположил (1778), что наличие в составе вещества кислорода обусловливает его кислотные свойства (именно эта гипотеза дала название кислороду как химическому элементу). Факт получения водорода (горючего воздуха) и кислорода (чрезвычайно чистого воздуха) из воды был установлен в 1783 году знаменитым изобретателем паровой машины Джеймсом Уаттом . В том же году Лавуазье проверил опыты Кавендиша и Пристли и уже вполне определённо заявил, что вода не есть элемент, но она может быть разложена и вновь соединена. Уатт узнал об этом объяснении Лавуазье и с чувством глубокой обиды написал одному из своих друзей:
Лавуазье знал о моей теории, но не упомянул ни в малейшей степени обо мне. Богатым людям дозволено совершать низкие дела.
— Цит. по
За последнюю четверть века химия обогатилась открытием различных газообразных веществ, среди которых так и не было найдено вещества, идентичного флогистону. Таким образом, к концу XVIII века произошёл переворот в теоретических взглядах химиков, обычно называемый «химической революцией». Открытия газов и окислительная теория Лавуазье повлекли за собой рационализацию химии. С этого времени изучение газов стало происходить исключительно на основе методов взвешивания, измерения объёма и давления.
Исследования газов в начале XIX века

Исследования действия газов (в особенности кислорода) на живые организмы, начатые Пристли и Шееле, породило хотя и кратковременное, но весьма любопытное модное увлечение, получившее название « ». Доктор Томас Беддо увлёкся перспективой применения газов для лечения заболеваний, в частности туберкулёза , с помощью ингаляции газов; его идеи встретили весьма горячий отклик и всяческую помощь в обществе . В марте 1799 года по инициативе Беддо на средства меценатов под Бристолем создаётся Пневматический институт — научно-лечебное учреждение с лабораториями, больницей на 10 коек и поликлиническим отделением . В институте широко проводились испытания ингаляций кислорода, водорода, азота и некоторых недавно открытых углеводородов , создавались и испытывались первые ингаляторы , спирометры , баллоны для сжатых газов и т. д. Исследования Беддо и его коллег заложили основу современной респираторной терапии: впервые был применён с лечебной целью кислород; разработаны основы аэрозольной терапии; измерена общая ёмкость лёгких методом разведения водорода.

.
В том же году свои работы по изучению газов начал приглашенный в Пневматический институт молодой химик Гемфри Дэви . Особое внимание Дэви уделил закиси азота . Наркотические свойства этого газа позволили Дэви ранее назвать его «веселящим» ( laughing gas ). В 1800 году Дэви описывает обезболивающее действие ингаляции закиси азота:
При прорезывании одного злосчастного зуба, называемого dentes sapientiae, я испытывал острое воспаление десны, сопровождающееся большой болью, которая одинаково мешала как отдыху, так и сознательной работе. Однажды, когда воспаление было чрезвычайно чувствительно, я вдохнул три большие дозы закиси азота. Боль совершенно исчезла после первых четырёх или пяти вдохов и неприятные ощущения на несколько минут сменились чувством удовольствия. Когда прежнее состояние сознания возвратилось, вместе с ним вернулось и состояние в органе, и мне даже показалось, что боль была сильнее после опыта, чем раньше"
— Цит. по

Большой заслугой Дэви за время работы в Пневматическом институте стала разработка методов очистки газов от ядовитых примесей. Дэви широко популяризировал свои открытия посредством публичных лекций в Королевском институте, созданного по инициативе Бенджамина Томпсона (графа Румфорда) , Джозефа Банкса и Генри Кавендиша . По словам современника, «… люди первого ранга и таланта, из литературного общества и науки, практики и теоретики, „синие чулки“ и великосветские дамы, старые и молодые — все жадно наполняли аудиторию » .
Интерес публики к ингаляциям «веселящего газа» был столь высок, что даже нашёл отражение в многочисленных памфлетах и карикатурах .
Общественный интерес к «пневматической медицине» быстро угас. Причиной тому было отсутствие какой-либо научной основы эмпирического применения газов при различных болезнях. Через некоторое время «пневматическая медицина» была объявлена шарлатанством и запрещена, Пневматический институт был закрыт уже в 1802 году.
Значительный вклад в изучение газов в этот период внесли Жозеф Луи Гей-Люссак и Джон Дальтон , начавшие в 1802 году независимые исследования упругости газов в зависимости от температуры, а также процессов парообразования. Гей-Люссак получил весьма точное значение коэффициента теплового расширения газов и установил, что это число одинаково для всех газов, несмотря на общепринятое мнение, что разные газы расширяются при нагревании различным образом ( закон Гей-Люссака ).

В 1808 году Гей-Люссак опубликовал небольшую заметку «О взаимном соединении газообразных веществ», содержащую результаты первых количественных исследований реакций между газами. Выводы, сделанные в этой статье оказались настолько важными, что впоследствии получили название закона объёмных отношений. Гей-Люссак установил, что "газы, действуя друг на друга, соединяются в простых отношениях, например 1 к 1, 1 к 2 или 2 к 3» . В те годы атомистическая теория делала только первые шаги, поэтому выводы Гей-Люссака были настоящим прорывом в области исследования структуры вещества. Гей-Люссак выяснил также, что это соотношение не меняется с температурой, вопреки общепринятым тогда представлениям, что количество элементарных частиц, составляющих газ, изменяется с температурой, причём в разных пропорциях для различных газов.
Результаты исследований Гей-Люссака легли в основу одного из важных основных положений химии, сформулированных в 1811 году Амедео Авогадро : «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул» .
Становление атомно-молекулярной теории положило конец периоду пневматической химии, ставшей частными разделами химии и физики.
Значение периода пневматической химии
Развитие пневматической химии и аналитических исследований во второй половине XVIII века оказало существенное влияние на представление химиков об элементах. Факт существования несколько видов воздуха свидетельствовали об укреплении представления о них как о химически индивидуальных веществах, в том числе формировалась гипотеза о существовании различных неразложимых на какие-либо компоненты и не трансмутируемых друг в друга элементов, сочетание которых образует химические соединения и обусловливает их свойства.
Расширение объектов химического исследования во второй половине XVIII в. привело к открытию настолько большого количества самых разнообразных экспериментальных фактов, что они уже не могли быть систематизированы в рамках теории флогистона. Ведущую роль здесь сыграли возникновение химии газов и постановка вопроса о весовых соотношениях. Теоретическое переосмысление химической информации рядом выдающихся исследователей положило начало первой химической революции: замене теории флогистона кислородной концепцией горения, пересмотру принятой системы составов химических веществ, переосмыслению концепции химического элемента и формированию представлений о зависимости свойств веществ от их качественного и количественного состава.
См. также
Примечания
- Priestley J. Experiments and Observations on Different Kinds of Airs. 6 vols. 1:228, 1774
- . Дата обращения: 4 сентября 2012. 21 июля 2017 года.
- Достаточно сказать, что известный поэт и изобретатель предоставил тысячу фунтов стерлингов в его распоряжение, а создатель паровой машины Джеймс Уатт снабжал его лаборатории необходимым оборудованием.
- . Дата обращения: 3 сентября 2012. 27 августа 2016 года.
- Цит. по от 3 декабря 2016 на Wayback Machine
Литература
- Азимов А. Краткая история химии. Развитие идей и представлений в химии. — М. : Мир, 1983. — 187 с.
- Джуа М. История химии. — М. : Мир, 1966. — 452 с.
- Фигуровский Н. А. Очерк общей истории химии. От древнейших времен до начала XIX века. — М. : Наука, 1969. — 455 с.
Ссылки
- 2021-12-12
- 1