Interested Article - Нуклеозидные амидофосфиты

- 2021-12-11
- 1
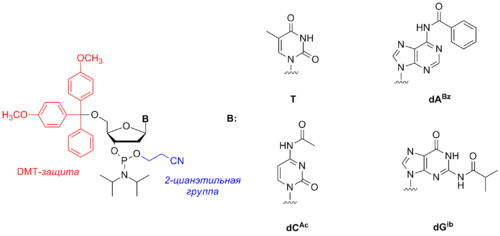
Нуклеозидные амидофосфиты — это производные природных или синтетических нуклеозидов , которые используются для синтеза олигонуклеотидов , относительно коротких фрагментов ДНК , и их аналогов. Нуклеозидные амидофосфиты были впервые предложены Бокажем (Beaucage) и Карузерсом (Caruthers) в 1981 году . Они представляют собой мономерные строительные блоки, последовательная конденсация которых друг к другу позволяет получить олигонуклеотидную цепь необходимой длины и последовательности, при этом в структуре амидофосфитного реагента остаток сахара и азотистое основание присутствуют в явном виде, а место фосфатного остатка занимает реакционноспособная амидофосфитная группа, которую в процессе синтеза превращают в фосфодиэфирную связь.
Кроме классических 2-дезоксирибонуклеозидных амидофосфитов существуют аналогичные реагенты на основе рибонуклеозидов , LNA, морфолино , 2'-модифицированных нуклеозидов, нуклеозидов с неканоническими основаниями или нуклеозидов, модифицированных флуоресцентным красителем или линкерной группой.
Синтез
Наиболее широко применяются два метода синтеза нуклеозидных амидофосфитов. Нуклеозидный амидофосфит можно получить путём введения в реакцию защищённого нуклеозида , содержащего лишь одну свободную гидроксильную группу, обычно, в 3'-положении, с бис( N , N -диизопропиламино)-2-цианэтоксифосфином в присутствии слабой кислоты в качестве катализатора . При этом происходит замещение одной диизопропиламинной группы с образованием новой связи P—O . Фосфитилирующий реагент является достаточно устойчивым и может быть синтезирован в две стадии с последующей очисткой вакуумной перегонкой .

В другом методе синтеза в качестве фосфитилирующего реагента используется N , N -диизопропиламино-2-цианэтоксихлорфосфин. Реакция между защищённым нуклеозидом и данным реагентом проводится в присутствии основания, обычно, диизопропилэтиламина .

Синтезированные нуклеозидные амидофосфиты очищают путём колоночной хроматографии на силикагеле. Чистота получаемого продукта может быть определена по 31 P ЯМР-спектрам. Хиральный атом P(III) даёт два сигнала, соответствующие двум диастереомерам , в области около 149 м. д. Примесный фосфитный триэфир может давать сигналы при 138—140 м. д., а H-фосфонат — при 8 и 10 м. д.
Устойчивость
Нуклеозидные амидофосфиты являются относительно устойчивыми соединениями, имеющими длительное время жизни при хранении в твёрдом виде в безводных условиях и в отсутствие воздуха при температуре ниже 4°C. Амидофосфиты хорошо выдерживают слабощелочные условия. Напротив, в присутствии следов кислот они разлагаются очень быстро. Амидофосфиты относительно устойчивы к гидролизу в нейтральной среде. Так, время полураспада амидофосфитного производного тимидина в 95%-ом водном ацетонитриле при 25°C составляет 200 ч.
Химические свойства
Основным свойством нуклеозидных амидофосфитов является их способность реагировать с нуклеофильными соединениями в присутствии катализатора, например, 1 H - тетразола , 2-этилтиотетразола , 2-бензилтиотетразола , 4,5-дицианимидазола и др. Данная реакция протекает весьма быстро и с высоким выходом, что позволяет применять нуклеозидные амидофосфиты синтезе олигонуклеотидов , где нуклеофилом служит 5'-гидроксильная группа растущей цепи. Стереохимическим результатом реакции является (образование двух диастереомеров) при хиральном атоме P(III).
Если нуклеофилом выступает вода, то амидофосфит превращается в H-фосфонат, что является распространённой проблемой при использовании неабсолютных растворителей в синтезе нуклеозидных амидофосфитов.

Амидофосфиты легко окисляются слабыми окислителями, например, йодом в присутствии слабого основания или пероксидом водорода с образованием соответствующих амидофосфатов . Подобным образом амидофосфиты реагируют и с другими халькогенами . При введении во взаимодействие с серой либо сульфурирующими реагентами амидофосфит количественно превращается в амидотиофосфат. Реакция с селеном или производными селена даёт амидоселенофосфаты. Конфигурация атома фосфора в реакциях подобного типа сохраняется.

Амидофосфиты также могут вступать в реакцию Арбузова с образованием соответствующих амидофосфонатов. В частности, описан синтез амидофосфонатов с участием акрилонитрила . При комнатной температуре реакция протекает стереоселективно с сохранением конфигурации при хиральном атоме Р. Если реакцию проводить при нагревании, образуется рацемический продукт.

См. также
Примечания
- Beaucage S. L., Caruthers M. H. Deoxynucleoside phosphoramidites — A new class of key intermediates for deoxypolynucleotide synthesis (англ.) // Tetrahedron Lett. — 1981. — Vol. 22 , no. 20 . — P. 1859–1862 . — doi : .
- ↑ Nielsen J., Dahl O. Improved synthesis of (Pr i 2 N) 2 POCH 2 CH 2 CN (англ.) // Nucl. Acids Res. — 1987. — Vol. 15 , no. 8 . — P. 3626 . — doi : .
- Nielsen J., Taagaard M., Marugg J. E., van Boom J. H., Dahl O. Application of 2-cyanoethyl N,N,N′,N′-tetraisopropylphosphorodiamidite for in situ preparation of deoxyribonucleoside phosphoramidites and their use in polymer-supported synthesis of oligodeoxyribonucleotides (англ.) // Nucl. Acids Res. — 1986. — Vol. 14 , iss. 18 . — P. 7391-7403 . — doi : .
- Sinha N. D., Biernat J., Köster H. β-Cyanoethyl N,N-dialkylamino/N-morpholinomonochloro phosphoamidites, new phosphitylating agents facilitating ease of deprotection and work-up of synthesized oligonucleotides (англ.) // Tetrahedron Lett. — 1983. — Vol. 24 , iss. 52 . — P. 5843–5846 . — doi : .
- Guzaev A. P., Manoharan M. 2-Benzamidoethyl Group − A Novel Type of Phosphate Protecting Group for Oligonucleotide Synthesis (англ.) // J. Am. Chem. Soc. — 2001. — Vol. 123 , iss. 5 . — P. 783–793 . — doi : .
- Sproat B., Colonna F., Mullah B., Tsou D., Andrus A., Hampel A., Vinayak R. An Efficient Method for the Isolation and Purification of Oligoribonucleotides (англ.) // Nucleosides and Nucleotides. — 1995. — Vol. 14 , no. 1-2 . — P. 255-273 . — doi : .
- Welz R., Müller S. 5-(Benzylmercapto)-1H-tetrazole as activator for 2′-O-TBDMS phosphoramidite building blocks in RNA synthesis (англ.) // Tetrahedron Lett. — 2002. — Vol. 43 , no. 5 . — P. 795–797 . — doi : .
- Vargeese C., Carter J., Yegge J., Krivjansky S., Settle A., Kropp E., Peterson K., Pieken W. Efficient activation of nucleoside phosphoramidites with 4,5-dicyanoimidazole during oligonucleotide synthesis (англ.) // Nucl. Acids Res. — 1998. — Vol. 26 , no. 4 . — P. 1046-1050 . — doi : .
- ↑ Gács-Baitz E., Sipos F., Egyed O., Sági G. Synthesis and structural study of variously oxidized diastereomeric 5′-dimethoxytrityl-thymidine-3′-O-[O-(2-cyanoethyl)-N,N-diisopropyl]-phosphoramidite derivatives. Comparison of the effects of the PO, PS, and PSe functions on the NMR spectral and chromatographic properties (англ.) // Chirality. — 2009. — Vol. 21 , no. 7 . — P. 663–673 . — doi : .
- Guzaev A. P. Reactivity of 3H-1,2,4-dithiazole-3-thiones and 3H-1,2-dithiole-3-thiones as sulfurizing agents for oligonucleotide synthesis (англ.) // Tetrahedron Lett. — 2011. — Vol. 52 , no. 3 . — P. 434–437 . — doi : .
- Holloway G. A., Pavot C., Scaringe S. A., Lu Y., Rauchfuss T. B. An Organometallic Route to Oligonucleotides Containing Phosphoroselenoate (англ.) // ChemBioChem. — 2002. — Vol. 3 , no. 11 . — P. 1061–1065 . — doi : .
- Ravikumar V. T., Kumar R. K. Stereoselective Synthesis of Alkylphosphonates: A Facile Rearrangement of Cyanoethyl-Protected Nucleoside Phosphoramidites (англ.) // Org. Proc. Res. Dev. — 2004. — Vol. 8 , no. 4 . — P. 603–608 . — doi : .
- 2021-12-11
- 1

