Физика
- 1 year ago
- 0
- 0

Атомная физика — раздел физики, изучающий строение и свойства атомов . Атомная физика возникла в конце XIX — начале XX века в результате экспериментов, установивших, что атом представляет собой систему из положительно заряженного ядра и отрицательно заряженных электронов, и получила своё развитие в связи с созданием квантовой механики , объяснившей структуру атома. Строение атомного ядра изучается в ядерной физике .
Атомная физика — раздел физики , изучающий строение и свойства атомов, ионов и электронных конфигураций , а также элементарных процессов, в которых они участвуют. Атомная физика оперирует линейными размерами около ⋅10 −8 см и энергиями порядка 1 эВ . Основной задачей атомной физики является определение всех возможных состояний атома. Основные разделы атомной физики — теория атома , атомная спектроскопия , рентгеноспектральный анализ , радиоспектроскопия , .
В основе современной атомной физики лежит квантово-механическая теория, которая описывает физические явления на атомно-молекулярном уровне. Атомная физика рассматривает атом, как систему из положительно заряженного ядра и отрицательно заряженных электронов . Свойства этой системы и элементарные процессы, протекающие в ней, определяются электромагнитным взаимодействием , в отличие от ядерной физики и физики элементарных частиц , где фундаментальную роль играют сильное взаимодействие и слабое взаимодействие .

Идея о существовании мельчайших неделимых частиц — атомов, впервые была сформулирована древнегреческими философами Левкиппом , Демокритом и Эпикуром . В XVII веке эта идея получила продолжение в трудах французских философов П. Гассенди и Р. Декарта , английского химика Р. Бойля . Атомистика этого периода носила скорее умозрительный характер, представления об атомах были, как о постоянных, неделимых частицах, разнообразных размеров и форм, лишённых химических и физических свойств, из сочетания которых состоят все материальные тела. В работах И. Ньютона и М. В. Ломоносова высказывались предположения о возможности соединения атомов в более сложные структуры — корпускулы .
Ускоренное развитие химии в конце XVIII — начале XIX веков привело к пересмотру некоторых аспектов атомистического учения. Английский учёный Дж. Дальтон сделал предположение о том, что атом — это мельчайшая частица химического элемента и атомы различных химических элементов имеют разную массу , которая является основной характеристикой атома. Работы итальянских учёных А. Авогадро и С. Канниццаро определили строгие разграничения между атомом и молекулой . В XIX веке также были открыты оптические свойства атомов, немецкими физиками Г. Кирхгофом и Р. Бунзеном было положено начало спектрального анализа. В 1869 Д. И. Менделеев открыл периодический закон химических элементов .
Важнейшими вехами в истории атомной физики были открытие электрона в 1897 английским физиком Дж. Дж. Томсоном и радиоактивного распада французскими учёными М. Склодовской-Кюри и П. Кюри , они изменили представление об атоме как о системе взаимодействующих заряженных частиц, согласно теории голландского физика Х. Лоренца . На основании этих исследований, Томсон предложил в 1903 году модель атома в виде сферы с положительным зарядом, с вкраплениями небольших по размеру частиц с отрицательным зарядом — электронов, удерживающихся в атоме за счёт равенства силы притяжения положительного заряда силам взаимного отталкивания электронов. Дальнейшие изучения радиоактивности Ф. Содди привели к открытию изотопов , тем самым разрушив научные представления об абсолютной идентичности всех атомов одного химического элемента. Важную роль сыграло также исследование А. Г. Столетовым фотоэффекта и дальнейшее объяснение этого явления А.Эйнштейном .
Модель Томсона была опровергнута в 1909 году его учеником Э. Резерфордом , который предложил планетарную модель атома , с находящимся в центре массивным положительным плотным ядром, вокруг которого, как планеты вокруг Солнца , летают электроны, число которых в нейтрально заряженном атоме таково, чтобы их суммарный отрицательный заряд компенсировал положительный заряд ядра. Г. Мозли выяснил, что заряд ядра увеличивается от одного химического элемента к следующему на одну элементарную единицу заряда, равную заряду электрона, но с противоположным знаком, а численно заряд атомного ядра, в единицах элементарного заряда, равен порядковому номеру элемента в периодической системе .
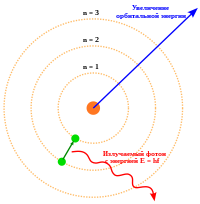
Планетарная модель атома обладала рядом недостатков, из которых самым существенным был связан с теоретически верной потерей энергии электрона: так как электрон вращается вокруг атома, то на него действует центростремительное ускорение, а согласно формуле Лармора любая заряженная частица, движущаяся с ускорением, излучает энергию. Если электрон теряет энергию, то в конце концов он должен упасть на ядро , чего в реальности не происходит. Уточнение модели атома стало возможным только с позиции совершенно новых представлений об атоме, открытых немецким физиком М. Планком , который вводит в науку понятия квантов . В 1905 году А. Эйнштейн предложил квантовое объяснение явления фотоэффекта , определив квант света как особую частицу, позднее названую фотоном . В 1913 году Н. Бор предположил, что электрон может вращаться не произвольно, а на строго определённых орбитах, не меняя своей энергии сколь угодно долгое время. Переход с орбиты на орбиту требует определённой энергии — кванта энергии .
Модель атома Бора получила экспериментальное подтверждение в опытах немецких физиков Дж. Франка и Г. Герца . Теория атомных спектров получила дальнейшее развитие в работах немецкого физика А. Зоммерфельда , который предположил более сложные эллиптические орбиты электронов в атоме. Квантовая теория атома объяснила структуру характеристических спектров рентгеновского излучения и периодичность химических свойств атомов. Однако с дальнейшим развитием атомной физики квантовая модель атома перестала отвечать уровню представлений об атоме. Французским физиком Л. де Бройлем было высказано предположение о двойственной природе движения микрообъектов, в частности электрона. Эта теория послужила отправным пунктом создания квантовой механики , в работах немецких физиков В. Гейзенберга и М. Борна , австрийского физика Э. Шрёдингера и английского физика П. Дирака ; и созданной на её основе современной квантово-механической теории атома .