Лиганд-зависимые ионные каналы
- 1 year ago
- 0
- 0
Лига́нд (от лат. «связывать») — атом , ион или молекула , связанные с другим атомом ( акцептором ) с помощью донорно-акцепторного взаимодействия . Понятие применяется в химии комплексных соединений , обозначая присоединенные к одному или нескольким центральным (комплексообразующим) атомам металла частицы.
Чаще всего такое связывание происходит с образованием так называемой «координационной» донорно-акцепторной связи , где лиганды выступают в роли основания Льюиса , то есть являются донорами электронной пары . При присоединении лигандов к центральному атому химические свойства комплексообразователя и самих лигандов часто претерпевают значительные изменения.
Собственно, важнейшая характеристика лиганда, позволяющая оценить и спрогнозировать его способности к комплексообразованию и саморазрушению D-орбитали — разрушения соединения в целом. В первом приближении включает в себя количество электронных пар, которые лиганд способен выделить на создание координационных связей и электроотрицательность донирующего атома или функциональной группы .

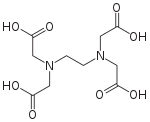
Число занимаемых лигандом координационных мест центрального атома (или атомов) называется дентатностью (от лат. dens, dent- — зуб ). Лиганды, занимающие одно координационное место, называются моно дентатными (например, N H 3 ), два — би дентатными (оксалат-анион [ O -C(=O)-C(=O) -O ] 2− ). Лиганды, способные занять большее количество позиций в координационной сфере, обычно обозначают как поли дентатные. Например, этилендиаминтетрауксусная кислота (EDTA), способная занять шесть координационных позиций.
Кроме дентатности, существует характеристика, отражающая количество атомов лиганда, связанных с одним координационным местом центрального атома. В английской литературе обозначается словом hapticity и имеет номенклатурное обозначение η с соответствующим надстрочным индексом. Хотя устоявшегося термина в русском языке она, по-видимому, не имеет, в некоторых источниках можно встретить кальку «гаптность» . Как пример, можно привести циклопентадиенильный лиганд в металлоцентровых комплексах, занимающий одно координационное место (то есть являющийся монодентатным) и связанный через все пять атомов углерода: η 5 -[C 5 H 5 ] − .

Лиганды с дентатностью больше двух способны образовывать хелатные комплексы ( греч. χηλή — клешня) — комплексы, где центральный атом включён в один или более циклов с молекулой лиганда. Такие лиганды называются хелатирующими . Как пример можно привести комплексы тетрааниона той же EDTA, обратив внимание, что несколько из четырёх связей M—O в нём могут формально являться ионными .
При образовании хелатных комплексов часто наблюдается хелатный эффект — большая их стабильность по сравнению с аналогичными комплексами не-хелатирующих лигандов. Он достигается за счёт большего экранирования центрального атома от замещающих воздействий и энтропийного эффекта. Например, константа диссоциации аммиачного комплекса кадмия [Cd(NH 3 ) 4 ] 2+ почти в 1500 раз больше, чем комплекса с этилендиамином [Cd(en) 2 ] 2+ . Причина этого заключается в том, что при взаимодействии гидратированного иона кадмия(II) с этилендиамином две молекулы лиганда вытесняют четыре молекулы воды. При этом число свободных частиц в системе значительно возрастает, и энтропия системы возрастает (а внутренняя упорядоченность комплекса соответственно растёт). То есть причина хелатного эффекта — увеличение энтропии системы при замещении монодентатных лигандов полидентатнымии и, как следствие, снижение энергии Гиббса .

Среди хелатирующих лигандов можно выделить класс макроциклических лигандов — молекул с достаточным для помещения атома комплексообразователя размером внутрициклического пространства. Примером таких соединений могут служить порфириновые основания — основы важнейших биохимических комплексов, таких, как гемоглобин , хлорофилл и бактериохлорофилл . Также в качестве макроциклических лигандов могут выступать краун-эфиры , каликсарены и др.
Лиганды также могут являться мостиковыми, образуя связи между различными центральными атомами в би- или полиядерных комплексах. Мостиковые лиганды обозначаются греческой буквой μ ( мю ).