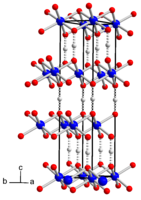
Метагидроксид кобальта
— неорганическое соединение, гидроксооксид металла
кобальта
с формулой CoO(OH), тёмно-коричневый аморфный осадок или чёрные кристаллы, не растворимые в воде.
Получение
В природе встречается минерал
— CoO(OH) с различными примесями.
4
C
o
(
O
H
)
2
+
O
2
→
100
o
C
,
p
4
C
o
O
(
O
H
)
↓
+
2
H
2
O
{\displaystyle {\mathsf {4Co(OH)_{2}+O_{2}\ {\xrightarrow {100^{o}C,p}}\ 4CoO(OH)\downarrow +2H_{2}O}}}
Окисление растворимой соли двухвалентного кобальта в щелочной среде:
4
C
o
C
l
2
+
O
2
+
16
(
N
H
3
⋅
H
2
O
)
→
4
C
o
O
(
O
H
)
↓
+
8
N
H
3
↑
+
8
N
H
4
C
l
+
10
H
2
O
{\displaystyle {\mathsf {4CoCl_{2}+O_{2}+16(NH_{3}\cdot H_{2}O)\ {\xrightarrow {}}\ 4CoO(OH)\downarrow +8NH_{3}\uparrow +8NH_{4}Cl+10H_{2}O}}}
Осаждение
щелочами
из раствора солей трёхвалентвого кобальта:
C
o
F
3
+
3
N
a
O
H
→
C
o
O
(
O
H
)
↓
+
3
N
a
F
+
H
2
O
{\displaystyle {\mathsf {CoF_{3}+3NaOH\ {\xrightarrow {}}\ CoO(OH)\downarrow +3NaF+H_{2}O}}}
Физические свойства
Метагидроксид кобальта образует чёрные кристаллы
тригональной сингонии
,
пространственная группа
R
3
m
, параметры ячейки
a
= 0,2851 нм,
c
= 1,3150 нм, Z = 3.
При высокой температуре и давлении переходит в другую модификацию
ромбической сингонии
,
пространственная группа
P bnm
, параметры ячейки
a
= 0,4353 нм,
b
= 0,9402 нм,
c
= 0,2840 нм, Z = 4.
Не растворяется в воде,
р
ПР
= 42,60.
Химические свойства
Разлагается при нагревании:
12
C
o
O
(
O
H
)
→
150
o
C
4
C
o
3
O
4
+
O
2
+
6
H
2
O
{\displaystyle {\mathsf {12CoO(OH)\ {\xrightarrow {150^{o}C}}\ 4Co_{3}O_{4}+O_{2}+6H_{2}O}}}
С концентрированными кислотами проявляет себя как окислитель:
2
C
o
O
(
O
H
)
+
6
H
C
l
→
2
C
o
C
l
2
+
C
l
2
+
4
H
2
O
{\displaystyle {\mathsf {2CoO(OH)+6HCl\ {\xrightarrow {}}\ 2CoCl_{2}+Cl_{2}+4H_{2}O}}}
4
C
o
O
(
O
H
)
+
4
H
2
S
O
4
→
100
o
C
4
C
o
S
O
4
+
O
2
+
6
H
2
O
{\displaystyle {\mathsf {4CoO(OH)+4H_{2}SO_{4}\ {\xrightarrow {100^{o}C}}\ 4CoSO_{4}+O_{2}+6H_{2}O}}}
4
C
o
O
(
O
H
)
+
8
H
N
O
3
→
80
o
C
4
C
o
(
N
O
3
)
2
+
O
2
+
6
H
2
O
{\displaystyle {\mathsf {4CoO(OH)+8HNO_{3}\ {\xrightarrow {80^{o}C}}\ 4Co(NO_{3})_{2}+O_{2}+6H_{2}O}}}
Примечания
Третьяков Ю.Д.
Неорганическая Химия. Химия элементов. Том 1. — 2-е. — МГУ; ИКЦ "Академкнига", 2007. — С. 442. — 537 с.
Литература
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. —
М.
: Советская энциклопедия, 1990. — Т. 2. — 671 с. —
ISBN 5-82270-035-5
.
Лидин Р.А. и др.
Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. —
М.
: Химия, 2000. — 480 с. —
ISBN 5-7245-1163-0
.
Рипан Р., Четяну И.
Неорганическая химия. Химия металлов. —
М.
: Мир, 1972. — Т. 2. — 871 с.