Interested Article - Оксид рутения(VIII)
- 2021-02-01
- 1
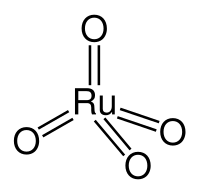
Оксид рутения(VIII) — неорганическое соединение, оксид металла рутения с формулой RuO 4 , жёлто-оранжевые кристаллы, умеренно растворимые в воде, образует гидраты .
Получение
- Окисление кислородом воздуха рутения при нагревании:
- Окисление рутения броматом калия :
- Разложение оксида рутения(IV) при нагревании:
- Окисление оксида рутения(IV) кислородом :
- Окисление тетраоксорутената(VI) калия хлором :
Физические свойства
Оксид рутения(VIII) образует жёлто-оранжевые кристаллы.
Тетраоксид рутения — летучее соединение и легко возгоняется .
При нагревании выше 100°С разлагается со взрывом. [ источник не указан 2230 дней ]
Сильный окислитель, пахнет озоном , со спиртом реагирует со взрывом.
Умерено растворяется в воде, водные растворы являются слабой кислотой p K 1 = 11,0.
Химические свойства
- Разлагается при нагревании:
- Является сильным окислителем. Реагирует с разбавленным раствором соляной кислоты:
- Взаимодействует с щелочами:
Примечания
- от 2 декабря 2017 на Wayback Machine , статья от 24.11.2017 г. с интервью заведующего Лабораторией Института ядерных исследований РАН Б. Жуйкова . Газета « Троицкий вариант — Наука ». Н. Демина.
Физиологическое действие
Тетраоксид рутения очень ядовит, летуч, сильный окислитель, поэтому он должен храниться в запаянных ампулах.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М. : Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4 .
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0 .
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М. : Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М. : Академия, 2007. — Т. 3. — 400 с.
- 2021-02-01
- 1






![{\displaystyle {\mathsf {RuO_{4}+10HCl\ \xrightarrow {} \ H_{2}[RuCl_{6}]+2Cl_{2}\uparrow +4H_{2}O}}}](/images/005/263/5263856/15.jpg?rand=96875)





