Дибромиддииодид олова(IV)
- 1 year ago
- 0
- 0
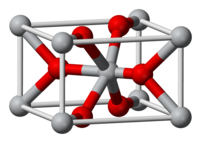
Окси́д о́лова(IV) ( диокси́д олова , двуо́кись олова, касситерит ) — бинарное неорганическое соединение , оксид металла олова с формулой SnO 2 . Белые кристаллы, нерастворимые в воде.
В природе встречается минерал касситерит — SnO 2 , основная руда олова, который в чистом виде бесцветен, однако примеси придают ему самые различные цвета.
Сжигание олова в воздухе или в кислороде при высокой температуре:
Окисление кислородом воздуха монооксида олова :
Диспропорционирование при нагревании монооксида олова :
Окисление олова горячей концентрированной азотной кислотой :
Разложение сульфата олова при нагревании:
или взаимодействием сульфата олова(IV) с разбавленной щёлочью :
Прокаливание на воздухе моносульфида олова :
Оксид олова(IV) из раствора при осаждении выделяется в виде гидрата переменного состава SnO 2 · n H 2 O, где так называемая α -модификация). При стоянии осадка переходит химически пассивную β -модификацию ( ). Соединения со стехиометрическим составом гидратов не выделены.
В воде практически нерастворим, р ПР = 57,32. Нерастворим также в этаноле и других не взаимодействующих с веществом растворителях.
При высушивании гидрата диоксида олова образуется аморфный белый порошок с плотностью 7,036 г/см³ , переходящий при нагревании в кристаллическую модификацию с плотностью 6,95 г/см³ .
Оксид олова(IV) образует прозрачные бесцветные кристаллы тетрагональной сингонии , пространственная группа P 4 2 / mnm , параметры ячейки a = 0,4718 нм , c = 0,3161 нм , Z = 2 , — кристаллическая структура типа рутила ( диоксида титана ).
Молярная энтропия
S
o
298
= 49,01 Дж/(моль·К)
. Теплоёмкость
C
o
p
= 53,2 Дж/(моль·К)
. Стандартная энтальпия образования
Δ
H
o
обр
= −577,63 кДж/моль
.
Является широкозонным полупроводником n -типа, при 300 К ширина запрещённой зоны 3,6 эВ , подвижность электронов 7 см 2 /(В·с) , концентрация носителей 3,5·10 14 см −3 , удельное электрическое сопротивление 3,4·10 3 Ом·см . Легирование элементами V группы, например, сурьмой увеличивает электрическую проводимость на 3—5 порядков .
Диамагнитен . Молярная магнитная восприимчивость χ mol = −4,1·10 −5 моль −1 .
Диоксид олова прозрачен в видимом свете, отражает инфракрасное излучение с длиной волны более 2000 нм .
Температура плавления 1630 °C . При высокой температуре испаряется с разложением на монооксид олова (и его ди-, три- и тетрамеры) и кислород .
Гидратированная форма переходит в кристаллическую при нагревании:
Растворяется в концентрированных кислотах:
При нагревании растворяется в разбавленных кислотах:
Растворяется в растворах концентрированных щелочей:
При сплавлении с щелочами и карбонатами образует мета станнаты :
а с оксидами щелочных металлов образует ортостаннаты:
В сочетании с оксидами ванадия его используют в качестве катализатора для окисления ароматических соединений в синтезе карбоновых кислот и ангидридов кислот, катализатора реакций замещения и гидролиза.
Плёнки из диоксида олова, нанесённые на стекло или керамику применяются в датчиках горючих газов в воздухе — метана , пропана , оксида углерода и других горючих газов. Нагретый до температуры в несколько сотен градусов Цельсия материал в присутствии горючих газов обратимо частично восстанавливается с изменением стехиометрического соотношения в сторону обеднения кислородом, что приводит к снижению электрического сопротивления плёнки . Для применения в датчиках газа изучалось легирование диоксида олова различными соединениями, например, оксидом меди(II) .
Основное применение соединения для создания прозрачных токопроводящих плёнок в различных приборах — жидкокристаллических дисплеях , фотогальванических элементах и в других приборах. Нанесение плёнки вещества производится из газовой фазы разложением летучих соединений олова, для повышения электропроводности соединение обычно легируют сурьмой и соединениями фтора .
Также применяется для создания прозрачных проводящих обогревательных противообледенительных плёнок на стеклянной поверхности окон транспортных средств.
Применяется в материалах контактов электрических коммутационных аппаратов, например, серебряных контактов электромагнитных реле — в материал вводят диоксида олова. Ранее для этой цели использовали весьма токсичный оксид кадмия .
Легирование кобальтом и марганцем дает материал, который можно использовать, например, в высоковольтных варисторах .
Легирование диоксида олова оксидами железа или марганца образует высокотемпературный ферромагнитный материал .
Диоксид олова плохо растворяется в расплавленной силикатной или боросиликатной стекломассе и имеет высокий показатель преломления относительно силикатного связующего, поэтому его микрочастицы в составе стёкол рассеивают свет, придавая стеклянной массе молочно-белый цвет и используется в производстве матовых стёкол, глазурованной керамической настенной плитке, сантехнических фаянсовых изделиях и др.
Изменяя состав стекломассы и технологию её приготовления можно изменять степень матовости продукта, так как растворимость диоксида олова увеличивается при повышении температуры обжига и увеличении концентрации в стекломассе оксидов щелочных металлов ( ) и оксида бора и снижается при увеличении содержания оксидов щелочноземельных металлов ( ), оксидов алюминия , цинка и свинца . Чистый диоксид олова придаёт глазури белый цвет, который можно изменить добавлением оксидов других элементов, например, оксид ванадия придаёт глазури жёлтый цвет, хрома — розовый, сурьмы — серовато-синий .
Тончайшие плёнки диоксида олова (~0,1 мкм) применяются в качестве адгезионного подслоя для нанесения на поверхность стеклянной посуды (в основном на бутылках, банках, сортовой посуде) полимерного покрытия, например, полиэтиленового . Нанесение таких тонких плёнок производится разложением на поверхности горячего стеклянного изделия летучих соединений олова, например, тетрахлорида олова или оловоорганических соединений , например, .
Микрокристаллы соединения имеют высокую твёрдость и применяется в составе полировальных паст и суспензий для полировки изделий из металлов, стекла, керамики, природных камней.
Соединение малотоксично, ЛД50 для крыс 20 г/кг перорально. Пыль соединения вредно влияет на органы дыхания. Предельно допустимая концентрация пыли в воздухе производственных помещений 2 мг/м 3 .