Связь в СССР
- 1 year ago
- 0
- 0

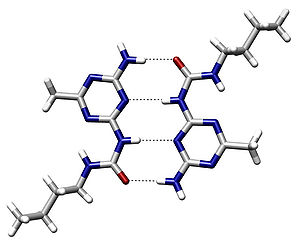
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H , связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N , O или F . Водородные связи могут быть межмолекулярными или внутримолекулярными .
Ранее водородную связь рассматривали как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи , невалентном взаимодействии между атомом водорода H , ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR' . Результатом таких взаимодействий являются комплексы RA-H···BR′ различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR′ .
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность , её распространенность и важность, особенно в органических соединениях , а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время с развитием квантовохимических расчетов в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H···[F-H···F]- ) или даже четырехцентровых пятиэлектронных связей (в случае образования ).
В книге The Nature of Chemical Bond and the Structure of Molecules and Crystals Лайнуса Полинга , впервые изданной в 1939 году, первое упоминание водородной связи приписывается Муру и Винмиллу. Они использовали водородную связь, чтобы обосновать факт, что гидроксид триметиламмония является более слабым основанием , чем гидроксид тетраметиламмония . Описание водородных связей в воде было сделано в 1920 году Латимером и Родебушем .
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль для нейтральных комплексов и 160 кДж/моль для ион-молекулярных комплексов). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры . Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород , вода , аммиак . Связь этого типа, хотя и слабее ионной и ковалентной связей, играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры ). Прочность водородной связи ( энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB) ± ; так, для комплекса (H 2 O•H•OH 2 ) + , образованного H 2 O и H 3 O + — 132 кДж/моль в газовой фазе.
Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных H-связей до 5—6).
Водородные связи повышают температуру кипения , вязкость и поверхностное натяжение жидкостей. Они ответственны за многие другие уникальные свойства воды.
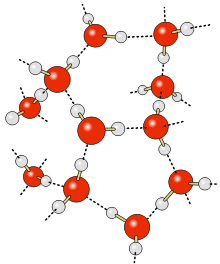
Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к возникновению так называемых водных кластеров или комплексов. Простейшим примером такого кластера может служить :
Энергия водородной связи в димере воды составляет 0,2 эВ (≈ 5 ккал / моль ), что всего на порядок больше, чем характерная энергия теплового движения при температуре 300 К. В то же время энергия ковалентной связи O-H в 200 раз больше тепловой энергии. Таким образом, водородные связи относительно слабы и неустойчивы: предполагается, что они могут легко возникать и исчезать в результате тепловых флуктуаций . Это, в частности, приводит к тому, что вода должна рассматриваться не как «простая», а как «связанная жидкость»: вода представляется как сеть молекул , соединённых водородными связями .
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты . В частности, элементы вторичной структуры (например, α-спирали , β-складки ) и третичной структуры в молекулах белков , РНК и ДНК стабилизированы водородными связями. В этих макромолекулах водородные связи сцепляют части той же самой макромолекулы, заставляя её сворачиваться в определённую форму. Например, двойная спиральная структура ДНК определяется в значительной степени наличием водородных связей, сцепляющих пары нуклеотидов, которые связывают одну комплементарную нить с другой.
Многие полимеры усилены водородными связями в их главных цепях. Среди синтетических полимеров самый известный пример — нейлон , где водородные связи играют главную роль в кристаллизации материала. Водородные связи также важны в структуре полученных искусственно полимеров (например, целлюлозы ) и в многих различных формах в природе, таких как древесина , хлопок и лён .
Для твердого тела в настоящее время разработан математический аппарат - метод расчета и анализа поверхности Хиршфельда , позволяющий точно оценивать вклад водородных связей в межмолекулярные взаимодействия. Применение этого метода позволяет также количественно сравнивать вклады различных типов межмолекулярных взаимодействий друг с другом.
При формировании биологических мембран (особенно фосфолипидных ) в клетках водородные связи играют определяющую роль, обеспечивая их векторность (направленность внешней поверхности мембран в сторону водной среды — субстрата).