Interested Article - Парвовирусы
- 2021-10-23
- 1
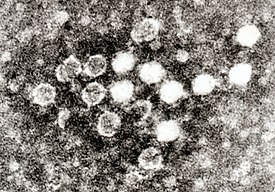
Парвовирусы ( лат. Parvoviridae , от лат. parvus — маленький) — семейство самых мелких ДНК -содержащих сферических вирусов , лишенных липопротеидной оболочки. Вирионы имеют диаметр 18—26 нм и содержат 60 капсомеров, тип симметрии икосаэдрический Т1. Геном вируса содержит одноцепочечную ДНК (геном около 5 kb), обычно имеющую две открытые рамки трансляции. Рамка считывания, расположенная на 5’-конце генома, кодирует неструктурные белки, а вирионные белки закодированы ближе к 3’-концу генома. На концах генома формируются шпилечные структуры .
Строение
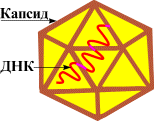
Вирионы парвовирусов представляют собой безоболочечные изометрические частицы с кубической симметрией диаметром 25 нм. Это довольно мелкие вирусы животных. Капсид парвовирусов состоит из 32 капсомеров диаметром 3—4 нм. Парвовирусы содержат одноцепочечную линейную ДНК размером 5,2 тн (19—32 % массы вирионов). Парвовирусы содержат 63—81 % белков. Сравнительным анализом некоторых автономных парвовирусов обнаружено различие в их структурных белках. Парвовирусы собак (ПВС), свиней (ПВСв), кошек (ПВК) и мышей (ПВМ) содержат по три структурных полипептида VP1, VP2, VP3 с молекулярной массой соответственно 79—82; 65—66 и 62—63 кД. Парвовирус крупного рогатого скота содержит четыре полипептида VP1, VP2, VP3 и VP4 с молекулярной массой соответственно 74,5; 67, 62 и 57 кД. Следует отметить, что у парвовируса свиней, выделенного при диарее (штамм Н-45), также обнаружено четыре структурных полипептида (81, 70, 66 и 62 кД). Основным белком у парвовирусов млекопитающих является VP3, на долю которого приходится около 80 % массы вирионных белков.
Капсид содержит 60 молекул белка VP2 (65 кД) и небольшое количество молекул VP1 (84 кД). VP1 и VP2 образуются альтернативным сплайсингом одной мРНК и полной последовательности VP2. Третий структурный белок VP3 образуется в полных (ДНК-содержащих) капсидах путём отщепления 15—20 аминокислот от аминоконца VP2. Зависимость размножения парвовируса от стадии клеточного цикла указывает на зависимость его репликации от репликации клеточной ДНК. Вирионы не содержат полимеразы, но способны кодировать такой фермент. Вместо этого используется клеточная полимераза И для транскрипции вирусной ДНК в двухспиральную промежуточную структуру, которая затем используется как матрица для других клеточных ферментов, катализирующих транскрипцию вирусных мРНК. Альтернативный сплайсинг структур приводит к увеличению отдельных видов мРНК , которые транслируются в большое количество различных белков. Наиболее обильный пул представлен мРНК, кодируемыми 3'-половиной генома, управляющей синтезом структурных белков. Неструктурный белок NS1, кодируемый 5'-половиной генома, также образуется в очень большом количестве и выполняет многие функции: 1) он связан с ДНК и требуется для репликации вирусной ДНК; 2) выполняет роль геликазы; 3) служит эндонуклеазой; 4) интерферирует с репликацией клеточной ДНК.
Эта активность ведет к остановке деления клеток в S фазе. Механизм репликации генома является удивительно комплексным. 3'-конец геномной (-)ДНК служит полупраймером для начала синтеза двуцепочечнои циркулярной ДНК в качестве репликативного предшественника. Одной из особенностей репликации геномной ДНК являлось образование димерной формы репликативного предшественника с последующим синтезом тетрамерной структуры, состоящей из двух полностью позитивных и двух полностью негативных цепей вирусной ДНК, которые с помощью эндонуклеазы превращаются в одноцепочечные молекулы, в том числе в потомство вирусной ДНК .
Особенности репликации
Поглощенная клеткой нуклеиновая кислота парвовируса поставляет свой геном в ядро клетки , где однонитевая ДНК преобразуется в двунитевую ДНК клеточными факторами и клеточной ДНК-полимеразой. Двунитевая ДНК-версия вирусного генома требуется для транскрипции и репликации . Репликация происходит только в растущих клетках. Вирусные белки синтезируются в цитоплазме и затем возвращаются в ядро, где собираются вирионы. В результате ядро и цитоплазма клетки дегенерируют. Вирусы освобождаются в результате лизиса клетки.
По способности к размножению в клетках хозяина парвовирусы делят на две группы — дефектные (род Dependovirus ) и автономные (остальные вирусы семейства Parvoviridae ). Автономные парвовирусы способны самостоятельно инициировать свою репродукцию, и для этого они используют соответствующие ферменты клетки хозяина, прежде всего клеточную ДНК-полимеразу . Репликация автономных парвовирусов происходит в ядрах клеток, находящихся в S-фазе клеточного цикла, то есть во время удвоения клеточной ДНК. Репликация парвовирусов, как правило, ограничена активно пролиферирующими тканями, что может вызывать аномалии развития у эмбрионов и поражения тканей новорождённого. Во взрослом организме парвовирусная инфекция часто протекает бессимптомно . Многие парвовирусы способны активно реплицироваться лишь в трансформированных и/или раковых клетках, не затрагивая при этом нормальные клетки организма . Именно это их свойство позволяет рассматривать парвовирусы как простейшие ДНК-содержащие вирусы, обладающие выраженной онколитической активностью.
Онколитическое действие парвовирусов
По всей вероятности, онкотропизм парвовирусов не связан с эффективным проникновением вируса в трансформированную клетку, а обусловлен преимущественной репликацией вируса в раковых клетках . При этом парвовирусы блокируют пути активации интерферонов первого типа, особенно в трансформированных фибробластах . Особую роль в онколитической активности парвовирусов играет основной неструктурный белок NS1 . Хеликазная активность NS1 необходима для репликации вируса , и он также является главным фактором, ответственным за онколитическую и цитотоксическую активность. Парвовирусный белок NS1 в относительно низкой концентрации способен вызвать гибель раковых клеток, но той же концентрации недостаточно для индукции апоптоза у клеток с нормальным фенотипом .
Парвовирусы могут также модулировать противоопухолевый иммунитет. В результате гибели опухолевых клеток, индуцированных парвовирусом, нередко высвобождаются антигены, характерные для раковых клеток и их молекулярные комплексы. Это стимулирует представление опухолевых антигенов иммунной системе организма и вызывает формирование более выраженного иммунного ответа против клеток опухоли .
Применение онколитических парвовирусов и векторных систем на их основе будет способствовать разработке подходов к лечению широкого круга болезней человека, в первую очередь онкологических заболеваний. Достигнутые в этой области успехи уже позволили перейти к проведению клинических испытаний для лечения злокачественных заболеваний.
Классификация
Последняя ревизия семейства была в 2013 году: изменены названия существующих и добавлены новые роды и виды .
Вирусы семейства парвовирусов делятся на два подсемейства — Densovirinae и Parvovirinae , паразитирующих на беспозвоночных и позвоночных соответственно. По данным Международного комитета по таксономии вирусов (ICTV) , на март 2017 года в подсемейства включают 5 и 8 родов соответственно :
-
Подсемейство
Densovirinae
- Род (11 видов)
- Род (2 вида)
- Род (1 вид)
- Род (5 видов)
- Род (1 вид)
- Виды incertae sedis (1 вид)
-
Подсемейство
Parvovirinae
-
Род
(2 вида)
- Вид [ syn. Aleutian mink disease virus ]
- Род (1 вид)
- Род (12 видов)
- Род (2 вида)
- Род (7 видов)
- Род (6 видов)
-
Род
(5 видов)
- Вид [syn. Minute virus of mice ]
- Род (6 видов)
-
Род
(2 вида)
Парвовирусы вызывают заболевания животных, поражая преимущественно желудочно-кишечный тракт и кроветворную систему. Некоторые представители данного рода обладают онколитическими свойствами (например, H-1 parvovirus , теперь включённый в вид ). Вид (ранее Aleutian mink disease virus ) вызывает алеутскую болезнь норок. Род вызывает поражения респираторного и желудочно-кишечного трактов человека , коров и собак.
Род объединяет аденоассоциированные вирусы человека , крупного рогатого скота, лошадей, овец, собак и птиц. В отличие от других парвовирусов, представители этого рода размножаются только в присутствии вирусов-помощников. Полноценными вирусами-помощниками могут служить аденовирусы , герпесвирусы также способны выполнять некоторые из необходимых функций вируса-помощника, однако полноценные инфекционные частицы парвовирусов в этом случае не образуются.
Примечания
- (англ.) на сайте Международного комитета по таксономии вирусов (ICTV) .
- Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева , А. С. Быкова . — М. : Медицинское информационное агентство, 2003. — С. 114. — ISBN 5-89481-136-8 .
- Maxwell I. H., Terrell K. L., Maxwell F. (2002). Autonomous parvovirus vectors. Methods 28 (2): 168—181.
- Tattersall P. (2006). The evolution of parvoviral taxonomy. In the parvoviruses. ed. J. R. Kerr, M. E. Bloom, R. M. Linden et al. Hodder Arnold: London P. 5—14.
- от 16 декабря 2013 на Wayback Machine // MedUniver.
- Berns K. I. (1990). Parvovirus replication. Microbiol Rev. 54 (3): 316—329.
- Rommelaere J., Giese N., Cziepluch C., Cornelis J. J. Parvoviruses as anti-cancer agents. (2005). In Viral therapy of human cancers. ed. J.G. Sinkovics, J.C. Horvath. Marcel Dekker: New York Р. 627—675.
- Rommelaere J., Cornelis J.J. (1991). Antineoplastic activity of parvoviruses. J Virol Methods 33 (3): 233—251.
- ↑ Cornelis J. J., Deleu L., Koch U. et al. (2006). Parvovirus oncosuppression in The parvoviruses. Hodder Arnold: London Р. 365—384.
- Randall R. E., Goodbourn S. (2008). Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures. J Gen Virol. 89 (1): 1—47.
- Rommelaere J., Geletneky K., Angelova A.L. et al. (2010). Oncolytic parvoviruses as cancer therapeutics. Cytokine Growth Factor Rev. 21 (2—3): 185—195.
- Cotmore S.F., Tattersall P. (1987). The autonomously replicating parvoviruses of vertebrates. Adv Virus Res. 33 : 91—174.
- Niskanen E. A., Ihalainen T. O., Kalliolinna O. et al. (2010). Effect of ATP binding and hydrolysis on dynamics of canine parvovirus NS1. J Virol. 84 (10): 5391—5403.
- Moehler M. H., Zeidler M., Wilsberg V. et al. (2005). Parvovirus H-1-induced tumor cell death enhances human immune response in vitro via increased phagocytosis, maturation, and cross-presentation by dendritic cells. Hum Gene Ther. 16 (8): 996—1005.
- : [ англ. ] : [ 18 мая 2015 ] // ICTVonline. — Code assigned: 2013.001a-aaaV. — 2013. — 65 p.
- (англ.) на сайте Международного комитета по таксономии вирусов (ICTV) . (Дата обращения: 26 марта 2017) .
- Chow B. D., Esper F. P. (2009). The human bocaviruses: a review and discussion of their role in infection. Clin Lab Med. 29 (4): 695—713.
Литература
- Mayo M. A., Pringle C. R. Virus taxonomy — 1997 // . (недоступная ссылка) — P. 649—657.
- Dimmock N. J., Easton A. J., Leppard K. . — Malden: Blackwell Publishing, 2007. — xiv + 516 p. — ISBN 1-4051-3645-6 . от 13 февраля 2015 на Wayback Machine
- Knipe D. M., Howley P. M., Griffin D. E., Lamb R. A., Martin M. A., Roizman B., Straus S. E. . — Philadelphia: Lippincott, Williams & Wilkins, 2007. — xix + 3091 p. — ISBN 0-7817-6060-7 .
- Локтев В. Б., Иванькина Т. Ю., Нетесов С. В., Чумаков П. М. // Актуальные вопросы онкологии. Вестник РАМН. — 2012. — № 2 . — С. 42—47 . 13 февраля 2015 года.
- 2021-10-23
- 1

