Interested Article - Талидомид
- 2021-02-12
- 1
Талидоми́д — седативное снотворное лекарственное средство , получившее широкую известность из-за своей тератогенности после того, как было установлено, что в период с 1956 по 1962 годы в ряде стран мира родилось по разным подсчётам от 8000 до 12 000 детей с врождёнными уродствами, обусловленными тем, что матери принимали препараты талидомида во время беременности. Талидомидовая трагедия заставила многие страны пересмотреть существующую практику сертификации лекарственных средств, ужесточив требования к сертифицируемым препаратам.
Талидомид был запрещен, но в 1998 году вновь допущен FDA для лечения проказы , однако Всемирная организация здравоохранения не рекомендует применять его для этой цели из-за возможных злоупотреблений при распространении .
Свойства

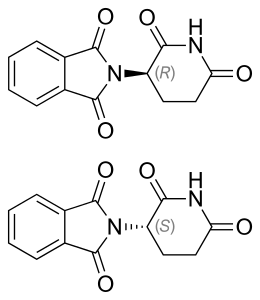
По физическим свойствам талидомид представляет собой белый кристаллический порошок, без вкуса и запаха. Он нерастворим в эфире и бензине , плохо растворим в воде, метаноле , этаноле и уксусной кислоте . Талидомид является производным глутаминовой кислоты , его молекула состоит из двух компонентов — фталимида и глутаримида . Температура плавления талидомида 271 °С . Молекула талидомида может существовать в виде двух оптических изомеров — право- и левовращающего .
История
Разработка и появление на рынке
В 1954 году немецкая фармацевтическая компания « Хеми Грюненталь » ( нем. Chemie Grünenthal ) проводила исследования с целью разработать недорогой способ производства антибиотиков из пептидов . В ходе исследований работниками компании был получен препарат, названный ими талидомид ( Thalidomid ), после чего начались изучения его свойств для определения сферы его применения.
Изначально талидомид предполагалось использовать как противосудорожное средство, однако первые опыты на животных показали, что подобными свойствами новый препарат не обладает. Вместе с тем было обнаружено, что передозировка препарата не убивала подопытных животных, что дало основание считать препарат безвредным.
В 1955 году Chemie Grünenthal неофициально выслала бесплатные образцы препарата разным докторам ФРГ и Швейцарии .
Люди, принимавшие препарат, отметили, что, хоть он и не проявляет противосудорожных свойств, но оказывает успокаивающий и снотворный эффект. Принимавшие препарат люди рассказывали, что они испытали глубокий «естественный» сон , длящийся всю ночь.
Действие препарата впечатлило многих терапевтов , безопасное успокаивающее и снотворное средство выделялось на фоне существующих снотворных препаратов. Безопасность передозировки (случайной или при попытке суицида ) препарата особо отмечалась в дальнейшем при продвижении этого продукта на рынке.
Несмотря на то что препарат оказывал на людей подобное воздействие, для его сертификации необходимо было показать эффективность его действия. Однако на животных препарат седативного воздействия не оказывал, поэтому представителям компании Chemie Grünenthal для демонстрации пришлось изготовить особую клетку, которая служила для измерения малейших движений подопытных животных. Таким образом представители компании Chemie Grünenthal сумели убедить комиссию, что, несмотря на то, что мыши после приёма препарата бодрствовали, их движения замедлялись в большей степени, чем у животных, которым ввели другие седативные средства. Основной акцент при демонстрации представители компании делали на то, что препарат абсолютно безопасен, что и позволило получить лицензию на производство и распространение препарата.
В 1957 году препарат был официально выпущен в продажу в ФРГ компанией Chemie Grünenthal (сейчас Grünenthal GmbH) под названием Contergan , в апреле 1958 года в Великобритании его выпустила фирма «Distillers Company» под названием Distaval . Кроме того, талидомид поставлялся на рынок в составе лекарственных средств для самых разных случаев, например, Asmaval — против астмы , Tensival — против повышенного кровяного давления , Valgraine — против мигрени . Всего талидомид поступил в продажу в 46 странах Европы, Скандинавии, Азии, Африки, Южной Америки, где он выпускался под 37 разными названиями. Никаких дополнительных независимых исследований препарата ни в одной стране не проводилось.
В августе 1958 года от компании Chemie Grünenthal кому-то поступило письмо, в котором отмечалось, что «талидомид — лучшее лекарство для беременных и кормящих матерей» . Этот пункт почти сразу же был отражён в рекламе средства в Великобритании компанией Distiller , несмотря на то, что исследования влияния препарата на плод не проводились ни немецкой компанией Chemie Grünenthal , ни английской Distiller . Талидомид стал успешно применяться для устранения неприятных симптомов, связанных с беременностью , таких как бессонница, беспокойство, утренняя тошнота.

Начиная с 1959 года , компания Chemie Grünenthal начала получать письма с сообщениями о периферическом неврите и других побочных эффектах от применения препарата. Появились мнения о том, что препарат следует продавать только по назначению врача. Несмотря на это, талидомид продолжал держать лидирующие позиции по продажам и в некоторых странах отставал по уровню продаж только от аспирина . Политика компании заключалась в отрицании связи препарата Contergan с периферическим невритом, и Chemie Grünenthal упорно сопротивлялась попыткам ограничить продажи препарата.
8 сентября 1960 года в США Richardson-Merrell Company представила талидомид на рассмотрение Управления контроля качества продуктов и лекарств ( англ. Food and Drug Administration , FDA ) США под названием Kevadon . Американские законы того времени для лицензирования лекарственного препарата требовали только безопасности его применения. Эти же законы допускали клиническое пробное применение лекарственного препарата до его лицензирования, что позволило компании Richardson-Merrell распространить более 2,5 млн таблеток 20 тысячам пациентов посредством 1267 терапевтов. Препарат был одобрен большинством врачей, которые сочли его безопасным и полезным, что они отразили в своих отчётах. Однако доктор Фрэнсис О. Келси , назначенная FDA для контроля над лицензированием препарата, оказалась не впечатлена результатами этого теста. Одним из основных факторов, повлиявших на решение Келси, было то, что компания Richardson-Merrell знала о риске развития невритов, но умолчала об этом в рапорте для FDA . Фрэнсис О. Келси, несмотря на серьёзное давление со стороны Richardson-Merrell , не одобрила препарат Kevadon , и он не поступил на рынок США.
К 1961 году талидомид стал самым продаваемым седативным средством в ФРГ.
Трагедия
25 декабря 1956 года в городе Штольберг в семье работника компании Chemie Grünenthal родилась дочь без ушей. Этот работник давал своей беременной жене ещё не выпущенный официально талидомид, который он взял на работе. В то время связи между приёмом препарата и пороком развития плода никто не усматривал, появление детей с врождёнными физическими дефектами неоднократно наблюдалось и ранее. Однако после поступления талидомида на рынок число рождающихся детей с врождёнными уродствами резко возросло. В 1961 году немецкий врач-педиатр Ганс-Рудольф Видеманн ( нем. Hans-Rudolf Wiedemann ) обратил внимание общественности на эту проблему , охарактеризовав её как эпидемию.
В конце 1961 года , почти в одно время, профессор Ленц ( нем. W. Lenz ) в Германии и доктор Макбрайд ( англ. McBride ) в Австралии выявили связь между возросшим числом врождённых пороков у новорождённых и тем фактом, что матери этих детей принимали талидомид на ранних сроках беременности.
16 ноября 1961 года Ленц сообщил о своих подозрениях в компанию Chemie Grünenthal по телефону. 18 ноября в газете Welt am Sonntag было опубликовано его письмо, в котором он описал более 150 случаев врождённых пороков у новорождённых и связал их с приёмом матерями талидомида на ранних стадиях беременности. 26 ноября под давлением прессы и немецких властей Chemie Grünenthal начала отзыв талидомида с рынка ФРГ, уведомив Richardson-Merrell , продукция которой успела распространиться на территории Южной Америки. При этом компания Chemie Grünenthal продолжала отрицать связь эпидемии с выпускаемым ею препаратом.
2 декабря Distillers объявила об отзыве препарата с рынков в открытом письме, опубликованном в английских журналах The Lancet и the British Medical Journal .
В декабре 1961 года в журнале The Lancet было опубликовано письмо Уильяма Макбрайда, в котором он также описал свои наблюдения относительно связи талидомида с врождёнными пороками у младенцев. После этого препарат начали убирать с прилавков в остальных странах. Подтверждения словам Ленца и Макбрайда стали поступать из разных стран, ситуация получила широкую огласку в газетах, по радио и на телевидении, однако, несмотря на это, препарат был доступен для покупки в некоторых аптеках и спустя полгода после первых сообщений. В Италии и Японии препарат продавался и спустя 9 месяцев после огласки.
В начале 1962 года Ленц сделал предположение, что, начиная с 1959 года , в ФРГ родилось примерно 2000 — 3000 детей — жертв талидомида . Всего, по различным оценкам, в результате применения талидомида приблизительно 40 000 человек получили периферический неврит, от 8000 до 12 000 новорождённых родились с физическими уродствами, из них лишь около 5000 не погибли в раннем возрасте, оставшись инвалидами на всю жизнь. Одним из таких детей был знаменитый немецкий певец Томас Квастхофф .
Судебное разбирательство
Федеративная Республика Германия
Начиная с конца 1961 года в прокуратуру Ахена начали поступать первые обвинения в адрес Chemie Grünenthal , и только к 1968 году были окончательно подготовлены материалы дела на 972 страницах. 27 мая 1968 года начался судебный процесс, ответчиками в котором являлись семь представителей компании Chemie Grünenthal , которые обвинялись в том, что допустили на рынок опасный медицинский препарат, не прошедший должной проверки и повлёкший за собой телесный ущерб у значительного числа детей. Также компания обвинялась в том, что не только не отреагировала должным образом на поступающие негативные отзывы о препарате, но и прилагала усилия к замалчиванию этой информации.
18 декабря 1970 года состоялось последнее заседание суда по этому делу, на котором было принято решение о закрытии дела в связи с предложенным 10 апреля 1970 года компанией Chemie Grünenthal обязательством выплатить компенсацию в 100 000 000 немецких марок детям, пострадавшим от действия талидомида. Суд постановил, что, учитывая всю систему производства и распространения лекарственных препаратов, подобное могло произойти с любой фармацевтической компанией, и первоочередной задачей является изменение существующей системы, а не сваливание вины за трагедию на нескольких человек.
17 декабря 1971 года Министерство здравоохранения ФРГ основало фонд Hilfswerk für behinderte Kinder , в задачу которого входила выплата компенсаций пострадавшим от действия талидомида. Выплаты начались в 1972 году и поначалу были достаточно малы — около 10 000 немецких марок , однако позже они увеличились, достигнув размера 100 000—180 000 немецких марок . Размер выплаты конкретному ребёнку зависел от степени нанесённого препаратом ущерба. Ежемесячные выплаты на ребёнка составляли 100 — 450 немецких марок, позже сумма ежемесячного платежа пересчитывалась и увеличивалась несколько раз (в 1976 , 1977 , 1980 и 1991 году ). Всего к началу 1992 года в качестве компенсации из фонда было выплачено приблизительно 538 000 000 немецких марок , компенсацию получили 2866 человек . Эти выплаты, в отличие от выплат Chemie Grünenthal , касались только жителей ФРГ.
Великобритания
В период с 1962 по 1966 год 70 родителей и опекунов детей, пострадавших от талидомида, подали исковые заявления против Distillers с обвинениями в халатности и выдвинули требования о возмещении ущерба. Кроме того, был подан ряд исков от людей, утверждавших, что получили периферический неврит, являющийся побочным эффектом от действия талидомида. Компания начала переговоры с целью разрешить вопросы по исковым заявлениям без доведения дел до суда. В 1968 году было урегулировано, в частности, 65 дел из 70, касающихся детей. Родителям или опекунам детей предлагалось отозвать иск о небрежности, в обмен на получение 40 % от суммы, которую они могли получить в случае успешного завершения судебного процесса. Таким образом, в 1968 году было отозвано 58 исков, за которые компания выплатила 1 000 000 фунтов стерлингов . После того, как суд разрешил подачу исков по этому делу, в том числе и по истечении определяемого законодательством трёхлетнего срока, начали поступать новые иски, из которых к 1971 году неурегулированными осталось 389. По всем этим искам компания Distillers пыталась договориться с истцами, не доводя дело до суда. Кроме того, было создано два списка истцов: список X — те, кто мог доказать, что являются жертвой талидомида, и список Y — те, кто не смог привести убедительных доказательств.
В 1971 году Distillers объявила решение об учреждении трастового фонда для помощи детям с врождёнными физическими недостатками, и к сентябрю проект фонда размером 3 250 000 фунтов стерлингов был готов. Проект предусматривал выплату этой суммы в качестве компенсации в течение десяти лет (не считая той компенсации, которая была выплачена по искам в пользу детей категории X отдельно).
24 сентября 1972 года в газете «Санди Таймс» ( англ. The Sunday Times ) появилась статья «Наши талидомидные дети — причина национального позора», в которой рассматривались предпринимаемые компанией Distillers шаги по урегулированию ситуации и указывалось на то, что предлагаемая компенсация не может быть сопоставима с ущербом, нанесённым английским семьям. Кроме того, в статье было указано, что размер компенсации в 3 250 000 фунтов стерлингов, по сравнению с годовым оборотом компании 64,8 миллионов фунтов стерлингов и активами в 421 миллион, ничтожно мал. Статья вызвала широкий резонанс, в СМИ поднялась волна интереса к этой теме, в связи с чем Distillers увеличила предполагаемый размер фонда до 5 000 000 фунтов стерлингов.
Кроме того, представители Distillers обратились к Генеральному прокурору, заявив, что эта статья, а также прочие упоминания обстоятельств этого дела в прессе являются проявлением неуважения к суду, так как дело ещё не закончено и подобные публикации способны подтолкнуть судей к принятию предвзятого решения. В ноябре 1972 года Верховный суд по иску Генерального прокурора выдал официальный запрет на эти публикации. Компания Times Newspapers Ltd подала апелляцию, найдя запрет на выполнение прямых обязанностей журналистов несправедливым. Апелляционный суд отменил решение Верховного суда, но 18 июля 1973 года Палата Лордов возобновила запрет на публикации, и он действовал до 23 июня 1976 года .
Однако давление со стороны общественности не прекращалось, и в декабре 1972 года компания предложила новый проект трастового фонда в размере 20 000 000 фунтов стерлингов , предусматривающий выплаты в течение 7 лет .
10 августа 1973 года был основан фонд Thalidomide Children’s Trust , в задачу которого входила поддержка детей-инвалидов, чьи матери принимали талидомид на ранних сроках беременности. Правительство Великобритании освободило выплаты детям-жертвам талидомидовой трагедии от налогообложения.
Так как значительная часть исков была отозвана в связи с договорённостью о выплате компенсаций, уголовного дела не возбуждалось и ответственности за случившееся никто из представителей Distillers не понёс.
Другие страны
В Японии реализацией талидомида занималась компания Dainippon Pharmaceutical Company . Она окончательно отозвала свои препараты, содержащие талидомид ( Isomin и Proban-M ), с рынка только 13 сентября 1962 года , то есть почти через 10 месяцев после того, как Contergan был отозван в Германии. Жертвами талидомида в Японии стало 309 детей. В ходе судебного разбирательства, в котором была задействована Dainippon и Министерство здравоохранения Японии, 26 октября 1974 года было достигнуто соглашение о выплате денежных компенсаций семьям, в которых родились дети с отклонениями, вызванными действием талидомида. По оценке доктора Ленца, принимавшего непосредственное участие в судебном разбирательстве, выплаты, полученные японскими детьми, были «значительно выше, чем выплаты в других странах».
В других странах были организованы аналогичные фонды. Единственная страна, где такого фонда не было, — Италия .
В США история с талидомидом также стала поводом для пересмотра и ужесточения требований к лицензированию лекарственных препаратов, в результате чего в закон «О продуктах питания, лекарствах и косметических средствах» ( англ. Federal Food, Drug, and Cosmetic Act ) в 1962 году было добавлено требование предъявления доказательств эффективности лицензируемого товара.
Возвращение на рынок
В 1964 году в Иерусалимском госпитале Хадасса Яков Шескин искал препарат, способный помочь смертельно больному пациенту, страдающему от тяжёлых воспалительных процессов, вызванных проказой . Среди больничных запасов он обнаружил талидомид. Доктор знал о том, что препарат запрещён, но, поскольку больной страдал от невыносимой боли, не мог нормально спать несколько недель и был фактически обречён, Шескин решил дать больному этот препарат, после приема которого больной наконец смог уснуть. После 20 часов сна больной смог впервые сам встать на ноги, а после последующего приёма талидомида его здоровье начало улучшаться. Такой же эффект от приёма препарата наблюдался и у шести других пациентов со сходными симптомами. Позже доктор провёл ряд исследований в Венесуэле , результаты которых показали, что из 173 пациентов, принимавших препарат, полностью излечились 92 %. Дальнейшие исследования Всемирной организации здравоохранения на 4552 больных проказой 99 % пациентов показали улучшение состояния здоровья. Таким образом, появились предпосылки для возвращения препарата на рынок.
Американский учёный-цитолог Джуда Фолкман одним из первых предположил, что для остановки развития злокачественной опухоли в организме необходимо прежде всего подавить её кровоснабжение. Долгое время учёный работал над созданием эффективного перорального препарата, подавляющего ангиогенез .
Профессор-офтальмолог Роберт Д’Амато ( Robert D’Amato ), работавший с 1992 по 1994 год в лаборатории Фолкмана в Гарвардском университете , предположил, что тератогенность талидомида связана с его антиангиогенными свойствами. В ходе испытаний на цыплятах и кроликах талидомид проявил себя как препарат, способный значительно снизить ангиогенез , что дало основания для рассмотрения возможности применения препарата в лечении тяжёлых онкологических заболеваний .
В 1997 году профессор Барт Барлоджи ( Bart Barlogie ) проверил, насколько талидомид эффективен против злокачественных опухолей . Он дал талидомид 169 пациентам Арканзасского Центра исследования рака, которым не помогала химиотерапия и пересадка костного мозга . У большинства пациентов замедлилось развитие злокачественных опухолей, через 18 месяцев после начала исследований половина этих пациентов были ещё живы — вопреки обычной статистике. После двухлетнего изучения препарата в 1999 году Барлоджи сделал официальное заявление о том, что талидомид способен помочь даже тем больным множественной миеломой , на которых не действуют стандартные методы лечения .
В 1990-е исследованиями талидомида начали активно заниматься учёные лаборатории американского профессора Джиллы Каплан ( Gilla Kaplan ) совместно с доктором Дэвидом Стирлингом ( David Stirling ) . Было установлено, что талидомид и открытые в ходе его изучения аналоги могут эффективно использоваться в лечении многих тяжёлых заболеваний, в том числе туберкулёза и СПИДа .
16 июля 1998 года FDA утвердило талидомид в качестве лекарства для лечения проказы . Так как после талидомидовой эпидемии FDA ввело дополнительные условия лицензирования лекарственных препаратов, производителям пришлось разработать сложную систему безопасности и обучения, включающую в себя строгий контроль за прописывающими препарат врачами и пациентами. В частности, пациентам вменяется в обязанность использовать максимально усиленную контрацепцию и запрещается быть донорами крови и спермы .
Негативное воздействие талидомида на организм
Тератогенное воздействие

Талидомид представляет наибольшую опасность на ранних стадиях беременности. Критический период для плода — 34 — 50 дней после последней менструации у женщины (от 20 до 36 дней после зачатия). Вероятность появления ребёнка с физическими деформациями появляется после приёма всего одной таблетки талидомида в этот промежуток времени.
Повреждения плода, вызванные талидомидом, касаются самых разнообразных частей тела. Среди наиболее распространённых внешних проявления выделяются дефекты или отсутствие верхних или нижних конечностей, отсутствие ушных раковин, дефекты глаз и мимической мускулатуры. Кроме того, талидомид влияет на формирование внутренних органов, разрушительным образом действуя на сердце , печень , почки , пищеварительную и мочеполовую системы , а также может приводить в отдельных случаях к рождению детей с отклонениями в умственном развитии, эпилепсией , аутизмом . Дефекты конечностей носят названия фокомелия и амелия (дословный перевод с греческого языка — это «тюленья конечность» и «отсутствие конечности» соответственно), которые проявляются в виде некоего подобия тюленьих ласт вместо конечности или практически полного их отсутствия.
Согласно собранным Ленцем данным, около 40 % новорождённых, подвергшихся воздействию препарата на стадии развития плода, умерли в течение первого года жизни. Некоторые разрушительные воздействия (в частности, касающиеся половой системы ребёнка) могут проявиться только через много лет после рождения и могут быть выявлены только в результате тщательного анализа.
Механизм тератогенного воздействия
Молекула талидомида может существовать в виде двух оптических изомеров — право- и левовращающего . Один из них обеспечивает терапевтический эффект препарата, в то время как второй является причиной его тератогенного воздействия. Тератогенный изомер не даёт расти кровеносным сосудам плода, нужным для его быстро размножающихся клеток . Этот изомер вклинивается в клеточную ДНК на участках, богатых G-C связями, и препятствует нормальному процессу репликации ДНК, необходимому для деления клеток и развития зародыша [ источник не указан 872 дня ] .
Поскольку в организме энантиомеры талидомида способны переходить друг в друга, препарат, состоящий из одного очищенного изомера, не решает проблему тератогенного воздействия.
Другие побочные эффекты
Кроме воздействия на плод, приём талидомида может негативно влиять и на принимающего препарат человека. К побочным явлениям могут относиться слабость, головная боль, сонливость, головокружение, нарушения менструального цикла, повышение температуры. В некоторых случаях приём талидомида может приводить к развитию периферического неврита .
Применение в современной медицине
В настоящее время талидомид применяется для лечения проказы , а также множественной миеломы и других серьёзных онкологических заболеваний. Применение препарата регулируется программой Pharmion Risk Management Program (PRMP) . Лечебный эффект талидомида связан с его противодействием росту сосудов, снабжающих кровью быстро размножающиеся клетки, вредным для обычных клеток плода, но полезным в борьбе против раковых клеток .
Отражение в культуре
В 1984 году Артур Хейли выпустил роман « Сильнодействующее лекарство ». В основу сюжета легла история разработки, распространения и последующего запрета талидомида. Главная героиня романа, подобно доктору Фрэнсис О. Келси, столкнулась с сильным давлением со стороны, пытаясь добиться дополнительных проверок препарата.
Том «И вечно прячется судьба» романа Ирвина Уэлша « Экстази. Три истории о любви и химии » посвящена теназадриновым детям. Автор создаёт альтернативную историю, в которой главные герои мстят создателю и главным причастным к разработке и раскрутке препарата лицам.
британского исторического драматического сериала «Вызовите акушерку» посвящён талидомидовой трагедии.
См. также
Примечания
- Sheryl Gay Stolberg (1998-07-17). . New York Times . из оригинала 3 декабря 2020 . Дата обращения: 8 января 2012 .
- . WHO:leprosy elimination . WHO. Дата обращения: 22 апреля 2010. 29 сентября 2010 года.
- William G. McBride. : [ англ. ] : [ 8 декабря 2015 ] // Teratology. — 1977. — Т. 16, № 1. — С. 79—82. — doi : .
- S. FABRO, R. L. SMITH & R. T. WILLIAMS. : [ 18 января 2016 ] // Nature. — 1967. — Т. 215, № 296. — doi : .
- (англ.) . Pharmion Pty Ltd. Дата обращения: 28 ноября 2015. 31 октября 2020 года.
- ↑ . Дата обращения: 14 декабря 2007. Архивировано из 2 февраля 2007 года.
- ↑ . Дата обращения: 4 декабря 2007. 7 января 2008 года.
- . Дата обращения: 23 ноября 2007. 23 ноября 2007 года.
- Lenz W. Thalidomide and congenital abnormalities. Lancet 1962;1:45.
- (недоступная ссылка)
- . Дата обращения: 4 декабря 2007. Архивировано из 7 января 2008 года.
- . Дата обращения: 5 декабря 2007. 7 января 2008 года.
- . Дата обращения: 28 ноября 2014. 6 декабря 2014 года.
- . Дата обращения: 10 декабря 2007. 21 мая 2009 года.
- . Дата обращения: 10 декабря 2007. 25 декабря 2011 года.
- . Дата обращения: 5 декабря 2007. Архивировано из 13 декабря 2014 года.
- (недоступная ссылка)
- Дата обращения: 10 декабря 2007. Архивировано из 7 января 2008 года.
- Дата обращения: 5 декабря 2007. Архивировано из 27 июня 2003 года.
- . Дата обращения: 5 декабря 2007. Архивировано из 20 июня 2010 года.
- . Дата обращения: 5 декабря 2007. 6 сентября 2005 года.
- Солдатенков А.Т. . — М. : Химия, 2001. — С. . — 192 с. — ISBN 5-7245-1184-3 .
- ↑ А. Рулёв (докт. хим. наук), В. Ерёмин (докт. физ.-мат. наук). Стереохимические фантазии Вант-Гоффа // Наука и жизнь . — 2020. — № 9 . — С. 57 .
- . Дата обращения: 6 декабря 2007. Архивировано из 29 февраля 2008 года.
- Singhal S. , Mehta J. , Desikan R. , Ayers D. , Roberson P. , Eddlemon P. , Munshi N. , Anaissie E. , Wilson C. , Dhodapkar M. , Zeddis J. , Barlogie B. (англ.) // The New England journal of medicine. — 1999. — Vol. 341, no. 21 . — P. 1565—1571. — doi : . — .
- . Дата обращения: 6 декабря 2007. Архивировано из 11 мая 2013 года.
Ссылки
-
 На
Викискладе
есть медиафайлы по теме
На
Викискладе
есть медиафайлы по теме
- (англ.)
- (англ.)
- (англ.)
- (англ.)
- от 19 сентября 2012 на Wayback Machine (англ.)
- 2021-02-12
- 1
