Решето поля функций
- 1 year ago
- 0
- 0
Теория кристаллического поля — квантовохимическая модель, в которой электронная конфигурация соединений переходных металлов описывается как состояние иона либо атома, находящегося в электростатическом поле , создаваемым окружающими его ионами, атомами или молекулами. Концепция кристаллического поля была предложена Беккерелем для описания состояния атомов в кристаллах и затем развита Хансом Бете и Джоном Ван Флеком для описания низших состояний катионов переходных металлов, окруженных лигандами — как анионами, так и нейтральными молекулами. Теория кристаллического поля была в дальнейшем объединена [и усовершенствована] с теорией (делокализованных) молекулярных орбиталей в более общую , учитывающую частичную ковалентность связи металл-лиганд в координационных соединениях .
Теория кристаллического поля позволяет предсказать или интерпретировать оптические спектры поглощения и спектры электронного парамагнитного резонанса кристаллов и комплексных соединений, а также энтальпий гидратации и устойчивости в растворах комплексов переходных металлов.
Согласно ТКП, взаимодействие между переходным металлом и лигандами возникает вследствие притяжения между положительно заряженным катионом металла и отрицательным зарядом электронов на несвязывающих орбиталях лиганда. Теория рассматривает изменение энергии пяти вырожденных d -орбиталей в окружении точечных зарядов лигандов. По мере приближения лиганда к иону металла, электроны лиганда становятся ближе к некоторым d -орбиталям, чем к другим, вызывая потерю вырожденности. Электроны d -орбиталей и лигандов отталкиваются друг от друга как заряды с одинаковым знаком. Таким образом, энергия тех d -электронов, которые ближе к лигандам, становится выше, чем тех, которые дальше, что приводит к расщеплению уровней энергии d -орбиталей.
На расщепление влияют следующие факторы:
Самый распространённый вид координации лигандов — октаэдрическая , при которой шесть лигандов создают кристаллическое поле октаэдрической симметрии вокруг иона металла. При октаэдрическом окружении иона металла с одним электроном на внешней оболочке d-орбитали разделяются на две группы с разностью энергетических уровней Δ окт ( энергия расщепления ), при этом энергия у орбиталей d xy , d xz и d yz будет ниже, чем у d z 2 и d x 2 - y 2 , так как орбитали первой группы находятся дальше от лигандов и испытывают меньшее отталкивание. Три орбитали с низкой энергией обозначаются как t 2g , а две с высокой — как e g .
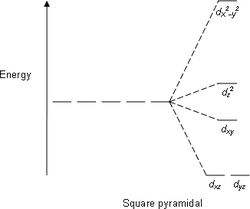
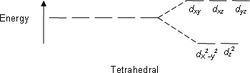
Следующими по распространённости являются тетраэдрические комплексы, в которых четыре лиганда образуют тетраэдр вокруг иона металла. В этом случае d -орбитали также разделяются на две группы с разностью энергетических уровней Δ тетр . В отличие от октаэдрической координации, низкой энергией будут обладать орбитали d z 2 и d x 2 - y 2 , а высокой — d xy , d xz и d yz . Кроме того, так как электроны лигандов не находятся непосредственно в направлении d -орбиталей, энергия расщепления будет ниже, чем при октаэдрической координации. С помощью ТКП также можно описать плоскоквадратную и другие геометрии комплексов.
Разность энергетических уровней Δ между двумя или более группами орбиталей зависит также от природы лигандов. Некоторые лиганды вызывают меньшее расщепление, чем другие, причины чего объясняет . Спектрохимический ряд — полученный опытным путём список лигандов, упорядоченных в порядке возрастания Δ:
I − < Br − < S 2− < SCN − < Cl − < NO 3 − < N 3 − < F − < OH − < C 2 O 4 2− < H 2 O < NCS − < CH 3 CN < py < NH 3 < en < < phen < NO 2 − < PPh 3 < CN − < CO
Степень окисления металла также влияет на Δ. Металл с более высокой степенью окисления ближе притягивает лиганды за счёт большей разности зарядов. Лиганды, находящиеся ближе к иону металла, вызывают большее расщепление.
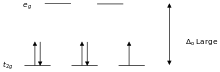
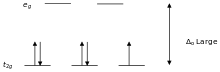
Лиганды, вызывающие большое расщепление d -уровней, например CN − и CO, называются лигандами сильного поля . В комплексах с такими лигандами электронам невыгодно занимать орбитали с высокой энергией. Следовательно, орбитали с низкой энергией полностью заполняются до того, как начинается заполнение орбиталей с высокой энергией. Такие комплексы называются низкоспиновыми . Например, NO 2 − — лиганд сильного поля, создающий большое расщепление. Все 5 d -электронов октаэдрического иона [Fe(NO 2 ) 6 ] 3− будут располагаться на нижнем уровне t 2 g .
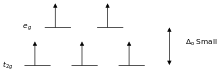
Напротив, лиганды, вызывающие малое расщепление, например I − и Br − , называются лигандами слабого поля . В этом случае легче поместить электроны в орбитали с высокой энергией, чем расположить два электрона в одной орбитали с низкой энергией, потому что два электрона в одной орбитали отталкивают друг друга, и затраты энергии на размещение второго электрона в орбитали выше, чем Δ. Таким образом, прежде чем появятся парные электроны, в каждую из пяти d -орбиталей должно быть помещёно по одному электрону в соответствии с правилом Хунда . Такие комплексы называются высокоспиновыми . Например, Br − — лиганд слабого поля, вызывающий малое расщепление. Все 5 d -орбиталей иона [FeBr 6 ] 3− , у которого тоже 5 d -электронов, будут заняты одним электроном.
Энергия расщепления для тетраэдрических комплексов Δ тетр примерно равна 4/9Δ окт (для одинаковых металла и лигандов). В результате этого разность энергетических уровней d -орбиталей обычно ниже энергии спаривания электронов, и тетраэдрические комплексы обычно высокоспиновые.
Диаграммы распределения d -электронов позволяют предсказать магнитные свойства координационных соединений. Комплексы с непарными электронами являются парамагнитными и притягиваются магнитным полем, а без — диамагнитными и слабо отталкиваются.
Энергия стабилизации кристаллическим полем (ЭСКП) — энергия электронной конфигурации иона переходного металла относительно средней энергии орбиталей. Стабилизация возникает вследствие того, что в поле лигандов энергетический уровень некоторых орбиталей ниже, чем в гипотетическом сферическом поле, в котором на все пять d -орбиталей действует одинаковая сила отталкивания, и все d -орбитали вырождены. Например, в октаэдрическом случае уровень t 2g ниже, чем средний уровень в сферическом поле. Следовательно, если в данных орбиталях находятся электроны, то ион металла более стабилен в поле лигандов относительно сферического поля. Наоборот, энергетический уровень орбиталей e g выше среднего, и электроны, находящиеся в них, уменьшают стабилизацию.
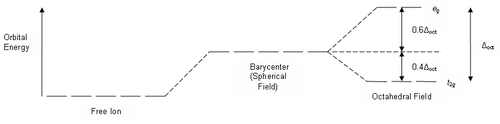
В октаэдрическом поле три орбитали t 2g стабилизированы относительно среднего энергетического уровня на 2 / 5 Δ окт , а две орбитали e g дестабилизированы на 3 / 5 Δ окт . Выше были приведены примеры двух электронных конфигураций d 5 . В первом примере — низкоспиновый комплекс [Fe(NO 2 ) 6 ] 3− с пятью электронами в t 2g . Его ЭСКП составляет 5 × 2 / 5 Δ окт = 2Δ окт . Во втором примере — высокоспиновый комплекс [FeBr 6 ] 3− с ЭСКП (3 × 2 / 5 Δ окт ) − (2 × 3 / 5 Δ окт ) = 0. В этом случае стабилизирующий эффект электронов в низкоуровневых орбиталях нейтрализуется дестабилизирующим эффектом электронов в высокоуровневых орбиталях.
| октаэдрическая | пентагонально-бипирамидальная | квадратно-антипризматическая |
|---|---|---|
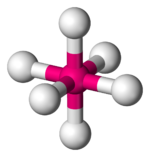
|
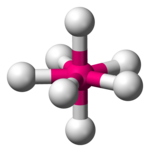
|

|

|
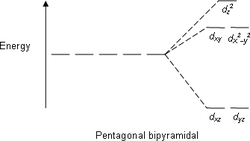
|
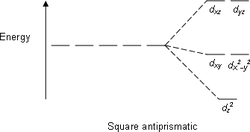
|
| плоскоквадратная | квадратно-пирамидальная | тетраэдрическая |
|
|
|
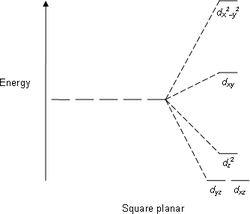
|
|
|
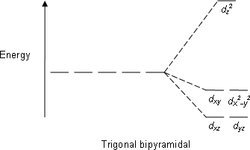
| тригонально-бипирамидальная | ||

|
||
|