Interested Article - Фталоцианины
- 2021-08-06
- 1


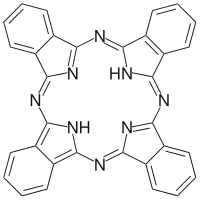
Фталоцианины — тетраазобензопорфирины, высшие гетероциклические соединения , состоящие из изоиндол ьных (бенз[c]пиррольных) колец, соединённые между собой через sp 2 -гибридизованный атом азота, структурно родственны порфиринам . Комплексы фталоцианинов с переходными металлами используются в качестве красителей и пигментов.
История открытия
Первое упоминание о странном тёмно-синем веществе, которое сейчас называется фталоцианином , относится к 1907 году . В 1927 году швейцарские исследователи пытались синтезировать фталонитрил из о-дибромбензола и цианида меди ( ). При этом получались синие соединения, среди которых были медь-замещённые фталоцианин, нафталоцианин, октаметилфталоцианин. Исследователи сообщали об удивительно высокой стабильности этих окрашенных соединений - они при высоких возгонялись без разложения и не разлагались концентрированными кислотами и щелочами - однако так и не смогли определить их природу . Толчком к детальному исследованию этих соединений также послужила случайность: в результате реакции, в которой ожидались только бесцветные продукты, был получен осадок тёмно-синего цвета. Целенаправлено фталоцианин меди впервые был получен Линстедом в 1934 году при нагревании динитрила фталевой кислоты с порошком меди . После 1934 началось интенсивное исследование металлированных и неметаллированных фталоцианинов.
Физические свойства
Тетраазопорфириновый цикл фталоцианинов представляет собой 18-электронную ароматическую систему , за счёт большой длины цепи сопряжения фталоцианины ярко окрашены, поглощая в видимом диапазоне в области примерно от 400 до 700 нм с коэффициентом молярной экстинции порядка 10 5 моль −1 см −1 , у незамещённого фталоцианина присутствует два пика поглощения - при 663,75 нм, 140793 моль −1 см −1 и 699 нм, 161453 −1 см −1 (в хлорнафталине) Введение электродонорных заместителей в бензольные фрагменты фталоцианина может приводить к батохромному сдвигу длинноволновой полосы поглощения до ~100 нм.
Фталоцианины и металлофталоцианины при нормальных условиях находятся в твёрдой фазе . Легко сублимируют и кристаллизуются , что позволяет получить очень чистые материалы.
Для фталоцианинов характерна высокая термическая стабильность: так, фталоцианин меди устойчив к кратковременному нагреву на воздухе до температур 400-500 °C, в вакууме — до 900 °C. При нагревании в вакууме в течение 5 суток при температуре 550-575 °C разлагается ~9% фталоцианина меди, при этом в газообразных продуктах разложения преобладает синильная кислота .
Растворяются в концентрированной серной , фосфорной , хлорсульфоновой , трихлоруксусной и трифторуксусной кислотах , при их разбавлении выпадают в осадок , растворимы в высококипящих органических растворителях ( нитробензол , хинолин ). При наличии объёмистых гидрофобных растворимость в неполярных растворителях повышается, сульфированые фталоцианины (фталоцианинсульфокислоты) растворимы в воде.
Химические свойства
Фталоцианины амфотерны: под действием сильных кислот происходит мостиковых атомов азота — вплоть до полного протонирования с образования тетрапротонированных солей под действием концентрированной серной и хлорсульфоновой кислот.
Водороды при пиррольных атомах азота подвижны и под действием оснований отщепляются с образованием дианиона. Пиррольные протоны также могут замещаться катионами металлов с образованием соответствующих солей либо комплексных соединений.
Фталоцианины, будучи ароматическими соединениями, вступают в реакции электрофильного замещения : они сульфируются, нитруются, галогенируются, реакционная способность комплексных металлоцианинов переходных металлов по сравнению со фталоцианинами понижена, так, например, если фталоцианин может быть хлорирован в суспензии в четырёххлористом углероде, то промышленный метод хлорирования фталоцианина меди — хлорирование в расплаве эвтектической смеси NaCl и AlCl 3 .
Под действием сильных окислителей ( K 2 Cr 2 O 7 , KMnO 4 , Ce(SO 4 ) 2 , концентрированной HNO 3 ) в присутствии воды происходит разрушение тертаазобензопорфиринового цикла с образованием соответствующих производных фталевых кислот, в отсутствие воды (избыток брома в метаноле, концентрированная HNO 3 в нитробензоле ) продуктом окисления металлофталоцианинов являются производные изоиндоленина.
Комплексообразование и фталоцианиновые красители
Фталоцианины образуют с катионами щелочных и щелочноземельных металлов (а также некоторых переходных металлов, например, Cd 2+ ) соединения солеобразного характера: они не растворимы в органических растворителях, не возгоняются и под действием кислот разлагаются, давая исходные фталоцианины. В случае ряда переходных металлов (Cu, Ni, Pd, Pt, Os) образуются высокоустойчивые комплексные соединения, способные к сублимации (фталоцианин меди сублимируется при атмосферном давлении при 550 °C), растворимые без деметаллирования в концентрированных кислотах и способные растворяться в органических растворителях.
Окрашенные комплексные фталоцианины переходных металлов — в первую очередь фталоцианин меди и его производные — устойчивы к нагреву и окислению и используются в качестве пигментов.
Получение
По изображению слева видно, что молекула фталоцианина состоит из четырёх одинаковых частей. На этом и базируется стратегия синтеза: в качестве исходных берут соединения, соответствующие данной части. Это различные производные фталевой кислоты : , , фталевый ангидрид , фталимид и .


Применение
Подавляющая часть производимых фталоцианинов ~90 % в виде комплексов фталоцианинов с переходными металлами используется в качестве пигментов. Наибольшее промышленное значение и, соответственно, долю в производстве, имеют медные комплексы. Незамещённый фталоцианин меди (CuPc) в кристаллических α- и β-формах широко применяется в качестве синего пигмента. Перхлорбромфталоцианины меди используются в качестве зелёных пигментов, сдвиг цвета от синего к жёлтому таких пигментов увеличивается с увеличением отношения бром/хлор.
Растворимые производные фталоцианинов используются также в качестве красителей. Натриевые соли медных комплексов фталоцианиндисульфокислоты CuPC(SO 3 Na) 2 (краситель Direct Blue 86, CAS ) и фталоцианинтетрасульфокислоты CuPC(SO 3 Na) 4 (краситель Acid Blue 249, CAS ) применяются как прямые красители для натуральных и синтетических волокон, бумаги и кожи. Производые фталоцианина кобальта (краситель Vat Blue 29, CAS ) используются в качестве кубовых красителей для целлюлозных волокон.
Также фталоцианины применяются для изготовления активного слоя CD-R дисков .
В качестве редокс-катализаторов фталоцианины переходных металлов нашли применение в процессах демеркаптанизации и обезвреживания .
Фталоцианин меди входит в состав известной смазки №158 с загустителем на основе литиевых и калиевых солей смоляных кислот канифоли (в первую очередь абиетаты калия и лития ) и жирных кислот касторового масла (получают омылением очищенного касторового масла щелочами , в данном случае гидроксидами лития и калия соответственно). Фталоцианин меди используется в качестве антиокислительной присадки, придаёт самой смазке №158 характерный синий цвет.
Примечания
- IUPAC Joint Commission on Biochemical Nomenclature (JCBN) . Дата обращения: 24 сентября 2020. 25 апреля 2021 года.
- de Diesbach, Henri; von der Weid, Edmond (1927). . Helvetica Chimica Acta . 10 (1): 886—888. doi : . eISSN . ISSN . Дата обращения: 25 сентября 2020 .
- R. P. Linstead, J. Chem. Soc., 1934, 1016; G. E. Ficken, R. P. Linstead, E. Stephen, M. Whalley, J. Chem. Soc. 1958, 3879.
- , с. 19.
- . OMLC . Дата обращения: 25 сентября 2020. 27 августа 2020 года.
-
Lawton, Emil A. (1958–03).
.
The Journal of Physical Chemistry
.
62
(3): 384—384.
doi
:
.
ISSN
. Дата обращения:
25 сентября 2020
.
{{ cite journal }}: Википедия:Обслуживание CS1 (формат даты) ( ссылка ) - Miles A. Dahlen. (EN) // Industrial & Engineering Chemistry. — ACS Publications, 2002-05-01. — Т. 31 , вып. 7 . — С. 839-847 . — doi : .
- . Дата обращения: 4 марта 2010. 28 сентября 2010 года.
- .
- .
Литература
- M. N. Kopylovich, V. Yu. Kukushkin, M. Haukka, K. V. Luzyanin, A. J. L. Pombeiro, J. Amer. Chem. Soc., 2004, 126, 15040.
- Ахмадуллина А. Г. , Кижаев Б. В. , Нургалиева Г. М. , Шабаева А. С. , Тугуши С. О. , Харитонов Н. В. // Нефтепереработка и нефтехимия : журнал. — 1994. — № 2 . — С. 39—41 .
- Ахмадуллина А. Г. , Кижаев Б. В. , Хрущева И. К. , Абрамова Н. М. , Нургалиева Г. М. , Бекбулатова А. Т. , Шабаева А. С. // Нефтепереработка и нефтехимия : журнал. — 1993. — № 2 . — С. 19—23 .
- Фараонов Максим Алексеевич. / Научный руководитель: доктор химических наук Конарев Дмитрий Валентинович. — Черноголовка: ФГБУН «Институт проблем химической физики РАН», 2016. — 146 с.
- 2021-08-06
- 1