Хэмптон, Лайонел
- 1 year ago
- 0
- 0
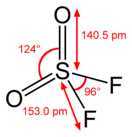
Сульфурѝлфтори́д — неорганическое соединение серы (VI), кислорода и фтора с формулой SO 2 F 2 (может рассматриваться как оксофторид серы). Бесцветный газ (при нормальных условиях) без запаха. Молекула сульфурилфторида имеет конфигурацию искажённого тетраэдра , с расположенным в центре шести валентным атомом серы .
Сульфурилфторид является дифторангидридом серной кислоты, однако он значительно менее реакционноспособен по отношению к нуклеофилам, чем хлористый сульфурил , напоминая своей инертностью гексафторид серы .
Сульфурилфторид растворим в воде (4,5 мл на 100 мл при 16,5 °C), однако его гидролиз в нейтральных и кислых растворах протекает медленно, и он может быть отогнан из таких растворов при пониженном давлении. При температуре выше +150°C быстро гидролизуется при избытке воды до фтороводорода и серной кислоты . При недостатке воды образуется фторсульфоновая кислота :
Сульфурилфторид является электрофилом и быстро гидролизуется в щелочных растворах до фторсульфоната:
Реакция протекает по механизму нуклеофильного замещения. В водных растворах цианидов сульфурилфторид быстро гидролизуется до сульфата.
Сульфурилфторид также быстро реагирует с водными растворами нуклеофилов: так, с аммиаком он образует сульфуриламид :
и с фенолятом натрия :
Впервые сульфурилфторид был получен Муассаном и Лебо фторированием диоксида серы , в качестве катализатора использовалась нагретая платина , так как при смешение газообразных фтора с диоксидом серы при комнатной температуре зачастую приводило к взрывам:
В лабораторной практике синтеза сульфурилхлорида обычно исходят из , получаемого взаимодействием фторида калия и диоксида серы :
Фторсульфинат калия далее может быть фторирован смесью фтора и воздуха в отношении 1:1, которую пропускают через никелевую трубку, заполненную солью, при температурах до 60—70°, выход почти количественный:
Сульфурилфторид также может быть получен из «безфторным» методом, в этом случае фторсульфинат натрия сначала хлорируется с образованием :
который далее вводится в реакцию с фторсульфинатом калия при 180 °C :
Сульфурилфторид с выходом 95-98 % может быть получен фторированием диоксида серы фторидом серебра(II) при 180°:
Сульфурилфторид также может быть получен термическим разложением фторсульфонатов двухвалентных металлов (бария, стронция и цинка, в случае фторсульфоната кальция при температуре разложения при 500° образуются лишь следовые количества сульфурилфторида):
Используется в сельском хозяйстве для борьбы с насекомыми , а также для фумигации зданий. Благодаря большей, чем у воздуха , плотности, сульфурилфторид высокоэффективен против обитающих в земле насекомых, например, против муравьёв и термитов .
Поскольку сульфурилфторид интенсивно поглощает в инфракрасной области и медленно разлагается в атмосфере, то он потенциально является парниковым газом (в 4000–5000 раз более сильным чем диоксид углерода ), однако вследствие малых масштабов производства он не вносит сколь-либо заметной доли в парниковый эффект .