Interested Article - Манганаты
- 2020-02-21
- 1

Мангана́ты — соли нестойких, несуществующих в свободном состоянии марганца в степенях окисления V, VI и VII и содержащие тетраэдрические анионы MnO 4 3− (гипоманганаты), MnO 4 2− (манганаты) и MnO 4 − (перманганаты) соответственно.
Перманганаты
Перманганаты, манганаты(VII) — соли нестойкой марганцовой кислоты HMnO 4 , известны для щелочных и щелочноземельных металлов. Кристаллы фиолетово-черного цвета, с зеленоватым блеском, растворимые в воде, растворы малиново-фиолетовые. Перманганаты лития, натрия и кальция образуют кристаллогидраты . Термически неустойчивы, разлагаются с выделением кислорода, образуя, в зависимости от условий, различные продукты. При умеренном нагревании разлагаются до манганатов(VI), например:
В присутствии восстановителей могут разлагаться со взрывом.
Перманганаты являются сильными окислителями, в щелочной среде восстанавливаются до манганатов MnO 4 2− , в нейтральной — до диоксида марганца MnO 2 , в кислой — до солей Mn 2+ . Используются в аналитической химии в качестве окислителей в редокс-титровании (перманганатометрия). Широко используются в качестве окислителей в органическом синтезе — при син-дигидроксилировании окислением алкенов, окисление боковых цепей ароматических соединений до карбоксильных групп и т. д.
Манганаты
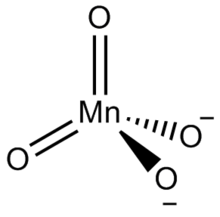
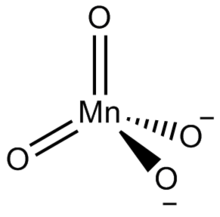
Манганаты(VI) — соли нестойкой марганцоватой кислоты H 2 MnO 4 , в кристаллическом состоянии известны только для щелочных металлов и бария . Кристаллы темно-зелёного цвета, растворы также зелёные. Термически неустойчивы, при нагревании разлагаются с выделением кислорода до MnO 2 и манганатов(V).
Манганаты(VI) — являются окислителями, в нейтральной среде восстанавливаются до соединений Mn(IV), в кислой — до Mn 2+ . В нейтральных и кислых растворах возможно диспропорционирование до перманганатов и соединений Mn(IV):
Сильными окислителями манганаты(VI) окисляются до перманганатов. Образуют двойные соли с сульфатами и хроматами.
Гипоманганаты
Гипоманганаты, манганаты(V) — соли нестойкой марганцоватистой кислоты H 3 MnO 4 , в кристаллическом состоянии известны только гипоманганаты лития, натрия, калия и бария. Кристаллы зелёного цвета. В водных растворах диспропорционируют до манганатов(VI) и диоксида марганца:
Манганиты
Соединения типа оксида марганца (IV) состава Me 2+ MnO 3 и Me 2+ 6 MnO 8 , (например, CaMnO 3 и Mg 6 MnO 8 ) являются не манганатами (IV), а двойными оксидами.
Применение
Наибольшее значение имеет перманганат калия , используемый как дезинфицирующее средство, при водоподготовке , в аналитической химии (редокс-титрование), органическом синтезе (окислитель). Манганаты бария используются в качестве пигментов (BaMnO 4 — касселева зелень, используемая в фресковой живописи , Ba 3 (MnO 4 ) 2 — в качестве голубого пигмента).
Ссылки
(таблица в Химической энциклопедии)
- 2020-02-21
- 1