Биологическое потребление кислорода
- 1 year ago
- 0
- 0
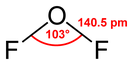
Фтори́д кислоро́да(II) ( дифтори́д кислоро́да ) — бинарное неорганическое соединение кислорода и фтора с формулой O F 2 . При нормальных условиях представляет собой бесцветный ядовитый газ , конденсирующийся при охлаждении в светло-жёлтую (в толстых слоях золотисто-жёлтую) жидкость . Фторид кислорода(II) имеет раздражающий запах , несколько отличающийся от запаха фтора (смесь запаха хлорной извести и озона ).
Дифторид кислорода был открыт впервые в 1929 году и , а спустя некоторое время подробно изучен Руффом и Менцелем.
В литературе иногда это соединение называют оксидом фтора (F 2 O). Однако это неверно, так как атом фтора более электроотрицателен , чем кислород, и по правилам IUPAC это соединение должно называться именно фторидом кислорода (OF 2 ), хотя общая электронная пара практически не смещается от атома кислорода в сторону атома фтора .
Жидкий фторид кислорода неограниченно смешивается с жидкими озоном , фтором , кислородом . Плохо растворяется в холодной воде (примерно 7:100 по объёму). При этом достаточно хорошо растворяет воздух .
Молекула обладает слабым дипольным моментом , равным 0,3 Д .
Чтобы получить чистый фторид кислорода взаимодействием воды со фтором, нужно проводить эту реакцию при −40 °C. Реакция идёт по радикально-цепному механизму:
Дифторид кислорода — весьма энергичный окислитель , и в этом отношении напоминает по силе свободный фтор, а по механизму окисления — озон, но реакции с участием фторида кислорода(II) требуют более высокой энергии активации , так как на первой стадии происходит образование атомарного кислорода (как и у озона). Термическое разложение фторида кислорода(II) представляет собой мономолекулярную реакцию с энергией активации 41 ккал/моль и начинается только при температуре выше 200 °C.
При растворении в горячей воде подвергается гидролизу . При этом образуется фтороводород и обычный кислород . В щелочной среде разложение протекает достаточно быстро.
Смесь паров дифторида кислорода и воды взрывоопасна:
Фторид кислорода(II) не действует на сухое стекло и кварц , но действует (интенсивно) на металлическую ртуть , что исключает применение ртути в приборах с фторидом кислорода(II). На смазку для газовых кранов фторид кислорода(II) действует очень медленно.
На меди , платине , золоте , серебре фторид кислорода(II) образует лишь тончайшие защитные плёнки фторидов , что позволяет использовать эти металлы в контакте с фторидом кислорода(II) при комнатной температуре. При повышении температуры до 250 °C происходит дальнейшее окисление металлов. Наиболее подходящими металлами для работы с дифторидом кислорода являются алюминий и магний . Нержавеющие стали , никель , монель-металл , магниевомедный сплав (92/8), латунь и медь также мало изменяются в весе при воздействии фторида кислорода(II) в течение 1...1,5 недели при 100 °C.
Благодаря высокой энергии активации разложения фторида кислорода(II), это соединение можно сравнительно безопасно смешивать с многими углеводородами , водородом , моноокисью углерода и прочими веществами, что чрезвычайно важно в практическом плане использования фторида кислорода(II) в качестве высокоэффективного окислителя ракетного топлива . Так как фторид кислорода(II) не взрывается при смешивании с горючими материалами и при нагревании (сам по себе) то его применение вполне безопасно.
Фторид кислорода(II) OF 2 (дифторид кислорода) чрезвычайно токсичен (степень токсичности сопоставима с таковой фосгена COCl 2 ), гораздо более ядовит , чем элементарный фтор , так как вызывает сильнейшее раздражение тканей организма, очень глубоко проникает и растворяется в них (глубже чем фтор), затрудняет дыхание. По токсикологии NFPA 704 ему присвоена высшая токсичность . Класс токсичности – 1.
Смертельная доза ( LC50 ) — 1—2 мг/(м 3 ·час) (даже меньше, чем у синильной кислоты ).
Дифторид кислорода опасен для окружающей среды .
В фантастической новелле Роберта Л. Форварда «Камелот 30К» дифторид кислорода был использован как биохимический растворитель для живых форм, живущих в поясе Койпера Солнечной системы . Хотя при 30 К фторид кислорода будет твёрдым, вымышленные инопланетные организмы являются эндотермическими и благодаря радиотермическому нагреву могут использовать жидкий фторид кислорода в качестве крови.