Терефталевая кислота
- 1 year ago
- 0
- 0
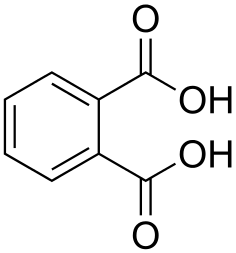
Фтáлевая кислотá ( ортофтáлевая кислотá , химическая формула — С 8 H 6 O 4 или C 6 H 4 (COOH) 2 ) — cлабая химическая органическая кислота , относящаяся к классу карбоновых кислот ароматического ряда .
При стандартных условиях , фталевая кислота — это простейшая двухосновная ароматическая карбоновая кислота , представляющая собой бесцветные моноклинные кристаллы, почти не имеющие запаха . Токсична
Соли и эфиры фталевой кислоты называются фтала́тами .
Фталевая кислота впервые была получена французским химиком Огюстом Лораном в 1836 году , который окисляя , получил ортофталевую кислоту. Полагая, что полученное им вещество является производным нафталина, он назвал его «нафталиновой кислотой». Швейцарский химик Жан Шарль Галиссар де Мариньяк определил формулу полученного вещества и указал на эту ошибку, и Лоран дал ему современное название .
Является изомером терефталевой и изофталевой кислот.
Фталевая кислота существует в виде бесцветных моноклинных кристаллов с т. пл. 211 °C. Её растворимость составляет 18,5 % в метаноле (19 °C), 11,0 % в этаноле (19 °C), 0,68 % в диэтиловом эфире (15 °C), 12,0 % в уксусной кислоте (100 °C), 0,24 % в четырёххлористом углероде (28 °C), 0,45 % в бензоле (28 °C), 2,89 % в ацетоне (28 °C). При повышении температуры её растворимость в воде увеличивается: 0,7 % при 25 °C, 1,47 % при 45 °C, 8,33 % при 85 °C, 19,0 % при 100 °C .
При нагревании фталевая кислота выделяет воду и превращается во фталевый ангидрид . Также она образует ангидрид при действии водоотнимающих реагентов. Под действием хлорида фосфора(V) она превращается в соответствующий .
Фталевая кислота вступает в реакции электрофильного замещения : в нейтральной водной среде она хлорируется с образованием 4-хлорпроизводного, а затем — 4,5-дихлорпроизводного. В кислой среде хлорируются все четыре незамещённых положения ароматического цикла. Нитрование фталевой кислоты приводит к 3- и 4-нитропроизводным .
Фталевая кислота декарбоксилируется в присутствии катализаторов при 200 °C до бензойной кислоты , а при 350 °C в присутствии оксида кадмия CdO — до бензола . Как и другие карбоновые кислоты , фталевая кислота образует соли и сложные эфиры по одной или двум карбоксильным группам , называемые фталатами .
Фталевая кислота не является промышленно значимым продуктом. Она образуется как побочный продукт при получении фталевого ангидрида . Однако фталевую кислоту можно получить в лаборатории путем окисления 1,2-диметилбензола подкисленным раствором перманганата калия .
В лабораторных условиях фталевую кислоту очищают кристаллизацией из воды .
Фталевая кислота — токсичное вещество . В соответствии с ГОСТ 12.1.007.76 фталевая кислота является токсичным высокоопасным веществом по степени воздействия на организм — 2-го класса опасности .
В больших количествах вещество раздражает слизистые оболочки глаз и кожи , вызывает .
Рекомендуемая ПДК в воздухе рабочей зоны для фталевой кислоты составляет — 0,5 мг/м 3 ; ЛД50 для крыс — около 136 мг/кг.
Как и многие другие производные бензола, фталевая кислота может быть токсична по отношению к донным микроорганизмам .
Ортофталевая кислота и ряд её производных ( диметилфталат , , фталевый ангидрид , , диэтилфталат ), используются в основном в производстве лекарственных средств, красителей и пластификаторов для мягкого поливинилхлорида .
Многие фталаты взрыво- и пожароопасны, характеризуются низкой степенью фитотоксичности .
Фталаты, имитирующие структуру эстрогена, могут вызывать нарушения в эндокринной системе. Исследования, проводившиеся на животных и людях, доказывают, что фталаты способны ослаблять действие тестостерона — основного мужского гормона позвоночных и человека, стимулирующего функцию мужских половых органов и развитие вторичных половых признаков.