Кондиционирование воздуха
- 1 year ago
- 0
- 0
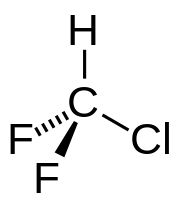
Дифторхлорметáн (также фреóн R-22 , хлàдагéнт R-22 , хладóн-22 ) — органическое вещество , трижды замещённый галогеналкан , производное метана , фреон , химическая формула CHClF 2 . Бесцветный газ со слабым запахом хлороформа . Более ядовит, чем дифтордихлорметан , не взрывоопасен и не горюч. По сравнению с дифтордихлорметаном, дифторхлорметан хуже растворяется в масле , но легко проникает через неплотности и нейтрален к металлам . При температуре выше 330 °C в присутствии металлов разлагается с выделением .
Дифторхлорметан широко используется в качестве хладагента , так как его примерно в 20 раз ниже, чем у фреонов R-11 ( трихлорфторметан и R-12 ( дифтордихлорметан ). Однако он всё же разрушает озоновый слой , поэтому его применение ограничено Монреальским протоколом . В 2020 году от него планируется полностью отказаться, заменив безопасными для озона фреонами, такими как тетрафторэтан (R-134A), R-410A ( азеотропная смесь R-32 и R-125), или .
Как и все фреоны , дифторхлорметан в природе не встречается.
Основной метод синтеза — взаимодействие хлороформа с фтороводородом в присутствии пентафторида сурьмы ( реакция Свартса ):
Дифторхлорметан в основном используется для получения тетрафторэтилена (идущего для производства политетрафторэтилена ) , реакция идет через образование дифторкарбена , образующегося при пиролизе дифторхлорметана (при 550—750 °С):
также образуется при отщеплении хлороводорода от дифторхлорметана действием оснований, при наличии в реакционной среде нуклеофилов дифторкарбен присоединяется к ним in situ с образованием дифторметильных производных:
| Свойство | Значение |
|---|---|
| Плотность при температуре кипения (жидкость/газ) | 1413/4,706 кг/м³ |
| Критическая плотность ( ρ c ) | 525 кг/м 3 |
| Коэффициент возможности истощения озонового слоя (ODP) | 0,055 (CCl 3 F = 1) |
| Потенциал глобального потепления (GWP) | 1810 ( CO 2 = 1) |