Interested Article - Бензолсульфохлорид
- 2021-03-28
- 1
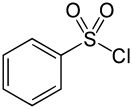
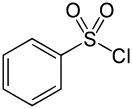
Бензолсульфохлорид ( бензолмоносульфохлорид, бензолсульфонилхлорид ) — органическое соединение, хлорангидрид бензолсульфокислоты. Жёлтая вязкая жидкость.
Получение
Основным лабораторным методом получения является реакция бензола и хлорсульфоновой кислоты . В колбу, снабжённую мешалкой и капельной воронкой, вносят 400 г хлорсульфоновой кислоты. Постепенно (на протяжении 3-х часов) к ней добавляют 100 г бензола, тщательно перемешивая каждую его порцию. Температура при этом должна составлять 0—10 °C. Затем смесь медленно выливают на лёд, масса которого составляет 120% от массы смеси. После отстаивания массы отделяют её нижний слой, состоящий преимущественно из бензолсульфохлорида, от верхнего водно-кислотного слоя. Бензолсульфохлорид промывают холодной водой несколько раз, сушат над хлоридом кальция и перегоняют в вакууме. При соблюдении данной методики выход продукта составляет около 70%. В данном случае протекает следующая реакция :
Возможен также метод получения бензолсульфохлорида, основанный на реакции бензолсульфоната натрия с хлорсульфоновой кислотой или пентахлоридом фосфора :
Ещё одним способом получения является взаимодействие бензолсульфокислоты с оксихлоридом фосфора :
Физические свойства
Бензолсульфохлорид при комнатной температуре представляет собой жёлтую/бесцветную вязкую жидкость с резким запахом, при температуре менее 14,5 °C переходящую в кристаллы ромбической сингонии .
Кипит при температуре 251,5 °C с разложением . Плотность составляет 1,395 г/см 3 при 4 °C, 1,384 г/см 3 при 15 °C и 1,377 г/см 3 при 25 °C .
Хорошо растворим в спирте , эфире , хлороформе , тетрахлорметане . Малорастворим в воде, холодной водой медленно гидролизуется .
| Температура, °C | 65,9 | 112,0 | 147,7 | 174,5 | 224,0 | 251,5 |
| Давление паров, кПа | 0,1 | 1,3 | 5,3 | 13,3 | 53,3 | 101,3 |
Химические свойства

- Гидролизуется водой. Медленно в холодной, быстро — при кипячении в присутствии кислот или оснований. При этом образуется бензолсульфокислота и соляная кислота .
- Взаимодействует с водным раствором аммиака или карбоната аммония в присутствии гидроксида или гидрокарбоната натрия с образованием бензолсульфамида .
- Реагирует со спиртами и эфирами, образуя эфиры бензолсульфокислоты — сульфонаты .
- Вступает в реакцию Фриделя-Крафтса . К примеру, с бензолом в присутствии кислоты Льюиса и при нагревании образует дифенилсульфон .
- Мягким восстановлением, например с помощью цинковой пыли или сульфита натрия , переводится в бензолсульфиновую кислоту .
- С помощью азотной кислоты в олеуме нитруется преимущественно в мета-положение .
- При нагревании до 200 °C разлагается с выделением сернистого газа .
Применение
Бензолсульфохлорид используется в качестве сырья для получения бензолсульфамида — исходного вещества для производства различных красителей, лекарственных веществ, а также монохлорамина Б (бензолсульфохлорамида натрия), представляющего собой дезинфицирующее и отбеливающее средство .
Своё применение бензолсульфохлорид нашёл и в органическом синтезе. Он используется в качестве сырья для получения различных алкильных эфиров бензолсульфокислоты, которые используются как мягкие алкилирующие реагенты .
Также используется в качестве одного из реагентов в пробе Хинсберга - качественной реакции для обнаружения первичных, вторичных и третичных аминов. Поэтому бензолсульфохлорид можно назвать реагентом Хинсберга.
Безопасность
Бензолсульфохлорид является горючим малолетучим веществом. Раздражающе воздействует на слизистые оболочки глаз и дыхательных путей, а также на кожу, чем представляет высокую опасность для человека. Не имеет выраженного кумулятивного действия .
В воздухе рабочей зоны производственных помещений рекомендуемая ПДК паров данного вещества составляет 0,3 мг/м 3 . В воде различных водоёмов санитарно-бытового водопользования ПДК составляет 0,5 мг/л .
Примечания
- ↑ , с. 369.
- , с. 524-525.
- ↑ , с. 270.
- ↑ , с. 368.
- ↑ , с. 271.
- , с. 340.
- , с. 162.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1. — 625 с.
- Промышленные хлорорганические продукты / под ред. Л. А. Ошина. — М. : Химия, 1978. — 656 с.
- В.Ф. Травень. Органическая химия. — М. : Академкнига, 2004. — Т. 2. — 582 с. — ISBN 5-94628-172-0 .
- Робертс Дж., Касерио М. Основы органической химии / под ред. А. Н. Несмеянова. — М. : Мир, 1978. — Т. 2.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
- 2021-03-28
- 1