Углерод
- 1 year ago
- 0
- 0
Углеро́д-14 ( 14 C, используются также названия радиоуглеро́д , радиокарбо́н и сокращение C-14) — радиоактивный нуклид химического элемента углерода с атомным номером 6 и массовым числом 14.
Углерод-14 является одним из природных радиоактивных изотопов. Первые указания на его существование были получены в 1936 году, когда британские физики У. Бёрчем и М. Голдхабер облучали медленными нейтронами ядра азота-14 в фотоэмульсии и обнаружили реакцию 14 N( n , p ) 14 C . В 1940 году углерод-14 смогли выделить американские физики и , облучавшие на циклотроне графитовую мишень дейтронами ; 14 C образовывался в реакции 13 C( d , p ) 14 C . Его период полураспада был установлен позже (Мартин Кеймен в своих первых экспериментах получил 2700 и 4000 лет , Уиллард Либби в 1951 году принял период полураспада в 5568 ± 30 лет ). Современное рекомендованное значение периода полураспада 5,70 ± 0,03 тыс. лет приведено в базе данных Nubase-2020 и основано на пяти экспериментах по измерению удельной активности, проведённых в 1960-х годах .
Углерод-14 образуется в верхних слоях тропосферы и стратосфере в результате поглощения атомами азота-14 тепловых нейтронов , которые в свою очередь являются результатом взаимодействия космических лучей и вещества атмосферы:
Сечение процесса 14 N(n, p) 14 C довольно высоко ( 1,83 барн ). Оно в 25 раз выше, чем сечение конкурирующего процесса — захвата теплового нейтрона 14 N(n, γ ) 15 N . Существуют и другие реакции, создающие в атмосфере космогенный углерод-14, в частности 13 C(n,γ) 14 C и 17 O(n,α) 14 C. Однако их скорость значительно ниже ввиду меньшей распространённости исходных нуклидов и меньших сечений реакции.
С наибольшей скоростью углерод-14 образуется на высоте от 9 до 15 км на высоких геомагнитных широтах, однако затем он равномерно распределяется по всей атмосфере. В секунду над каждым квадратным метром земной поверхности в среднем образуется от 16 400 до 18 800 атомов углерода-14 , хотя скорость образования может колебаться в зависимости от солнечной активности и других факторов. Обнаружены резкие и короткие увеличения скорости образования 14 C ( события Мияке ), предположительно связанные с очень мощной солнечной вспышкой или близким гамма-всплеском , например событие в 774 году н. э. , когда в атмосфере одномоментно возникло в три с лишним раза больше радиоуглерода, чем в среднем образуется за год.
Ещё один природный канал образования углерода-14 — происходящий с очень малой вероятностью кластерный распад некоторых тяжёлых ядер, входящих в радиоактивные ряды . В настоящее время обнаружен распад с эмиссией углерода-14 ядер 224 Ra (ряд тория), 223 Ra (ряд урана-актиния), 226 Ra (ряд урана-радия); предсказан, но экспериментально не обнаружен аналогичный процесс для других природных тяжёлых ядер (кластерная эмиссия углерода-14 обнаружена также для отсутствующих в природе нуклидов 221 Fr , , и 225 Ac ). Скорость образования радиогенного углерода-14 по этому каналу пренебрежимо мала по сравнению со скоростью образования космогенного углерода-14 .
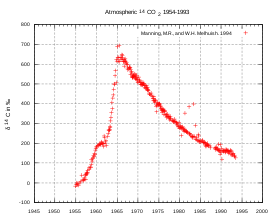
При испытаниях ядерного и особенно термоядерного оружия в атмосфере в 1940—1960-х годах углерод-14 интенсивно образовывался в результате облучения атмосферного азота тепловыми нейтронами от ядерных и термоядерных взрывов. В результате содержание углерода-14 в атмосфере сильно возросло (так называемый «бомбовый пик», см. рис.), однако впоследствии стало постепенно возвращаться к прежним значениям ввиду ухода в океан и прочие резервуары. Другой техногенный процесс, повлиявший на среднее отношение [ 14 C]/[ 12 C] в атмосфере, действует в направлении уменьшения этой величины: с началом индустриализации (XVIII век) значительно увеличилось сжигание угля, нефти и природного газа, то есть выброс в атмосферу древнего ископаемого углерода, не содержащего 14 C (так называемый ) .
Ядерные реакторы, использующие воду в активной зоне, также являются источником техногенного загрязнения углеродом-14 , также как и реакторы с графитовым замедлителем .
Общее количество углерода-14 на Земле оценивается в 8500 пета беккерелей (около 50 тонн ), в том числе в атмосфере 140 ПБк ( 840 кг ). Количество углерода-14, попавшего в атмосферу и другие среды в результате ядерных испытаний, оценивается в 220 ПБк ( 1,3 тонны ) .
Углерод-14 претерпевает β − -распад , в результате распада образуется стабильный нуклид (выделяемая энергия 156,476(4) кэВ ):
Скорость распада не зависит от химических и физических свойств окружения. Грамм атмосферного углерода содержит около 1,5×10 −12 г углерода-14 и излучает около 0,6 бета-частиц в секунду за счёт распада этого изотопа. С этой же скоростью углерод-14 распадается и в человеческом теле; каждую секунду в организме человека происходит несколько тысяч распадов. Ввиду малой энергии образующихся бета-частиц мощность эквивалентной дозы внутреннего облучения, получаемого по этому каналу (0,01 м Зв /год, или 0,001 бэр /год), невелика по сравнению с мощностью дозы от внутреннего калия-40 (0,39 мЗв/год) . Средняя удельная активность углерода-14 живой биомассы на суше в 2009 году составляла 238 Бк на 1 кг углерода, близко к значениям до бомбового пика ( 226 Бк/кг C ; 1950) .
Углерод-14 является вторым (после калия-40 ) по значимости источником неустранимой собственной радиоактивности человеческого организма . Его вклад в радиоактивность условного среднего человеческого тела массой 70 кг по различным оценкам составляет 3,1 —3,7 кБк .
Углерод-14 постоянно образуется в атмосфере из под воздействием космических лучей. Для современного уровня космической активности можно оценить относительное содержание углерода-14 по отношению к «обычному» (углероду-12) в атмосфере как примерно 1:10 12 . Как и обычный углерод , 14 C вступает в реакцию с кислородом , образуя углекислый газ , который нужен растениям в процессе фотосинтеза . Люди и различные животные затем потребляют растения и изготовленные из них продукты в пищу, усваивая таким образом и углерод-14. При этом соотношения концентраций изотопов углерода [ 14 C]: [ 13 C]: [ 12 C] сохраняются практически такими же, как в атмосфере; изотопное фракционирование в биохимических реакциях изменяет эти соотношения лишь на несколько промилле, что может быть учтено .
В умершем живом организме углерод-14 постепенно распадается, а стабильные изотопы углерода остаются без изменений. То есть соотношение изотопов изменяется с течением времени. Это позволило использовать данный изотоп для установления возраста методом радиоизотопного датирования при датировании биоматериалов и некоторых неорганических образцов возраста до 60 000 лет . Наиболее часто используется в археологии, в ледниковой и постледниковой геологии, а также в физике атмосферы, геоморфологии, гляциологии, гидрологии и почвоведении, в физике космических лучей, физике Солнца и в биологии, не только для датировок, но и как трассёр различных природных процессов .
Используется для определения заражения желудочно-кишечного тракта Helicobacter pylori . Пациенту дают препарат мочевины с содержанием 14 C. В случае инфекции H.pylori бактериальный фермент уреазы разрушает мочевину в аммиак и радиоактивно меченый углекислый газ, который может быть обнаружен в дыхании пациента . Сегодня тест на основе меченых атомов 14 C стараются заменять на тест со стабильным 13 C, который не связан с радиационными рисками.
В России радиофармпрепараты на основе 14 C производит Обнинский филиал Научно-исследовательского физико-химического института имени Л. Я. Карпова .
Существует концепция использования углерода-14 в качестве радиоизотопного источника энергии. В нём содержится алмазоподобное покрытие из 14 C в качестве источника бета-излучения и дополнительное такое же покрытие с нормальным углеродом для создания необходимого полупроводникового перехода и инкапсуляции углерода-14. Такая батарея будет вырабатывать небольшое количество электроэнергии в течение тысяч лет .