Interested Article - Миеломная болезнь
- 2021-06-05
- 1
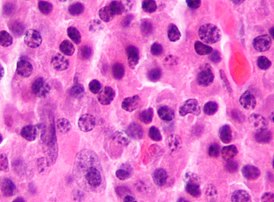
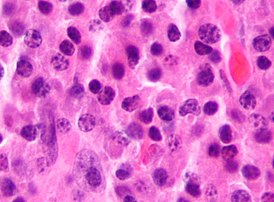
Миеломная болезнь (от др.-греч. μυελός — костный мозг и -ωμα — окончание в названиях опухолей, от ὄγκωμα — опухоль), множественная миелома , генерализованная плазмоцитома или болезнь Рустицкого - — злокачественная опухоль из плазматических клеток (дифференцированных B-лимфоцитов , продуцирующих антитела ). Заболевание системы крови , относящееся к парапротеинемическим лейкозам . Своё название заболевание и опухолевая клетка получили в связи с преимущественной локализацией процесса в костном мозге .
Диагностические критерии
В 2003 году Международная рабочая группа миеломы разработала диагностические критерии для симптоматической миеломы, бессимптомной миеломы и MGUS (моноклональной гаммапатии неопределённого значения), которые были обновлены в 2009 :
-
Симптоматическая миелома
- Плазматические (клональные) клетки в костном мозге больше 10 % или в любом количестве в биоптате из других тканей;
- Моноклональный белок (парапротеин) в сыворотке или в моче (за исключением случаев истинной несекретирующей миеломы);
-
Поражение органов-мишеней, вероятно связанных с плазмоклеточной пролиферацией (обычно называют англоязычной аббревиатурой «CRAB»):
- Гиперкальциемия (содержание кальция крови > 2,75 ммоль / л)
- Почечная недостаточность , объясняемая миеломой
- Анемия (гемоглобин <100 г/л)
- Костные поражения ( литические повреждения или остеопороз с компрессионными переломами )
-
Бессимптомная/тлеющая миелома
- Парапротеин сыворотки > 30 г/л и/или
- Плазматические (клональные) клетки в пунктате КМ > 10 % и
- Нет органных поражений, связанных с миеломой
-
Моноклональная гаммапатия неопределенного значения (MGUS)
- Парапротеин сыворотки <30 г/л
- Плазматические (клональные) клетки в пунктате КМ <10 % и
- Нет органных поражений, связанных с миеломой
Эпидемиология
Чаще заболевают люди в пожилом возрасте. Случаи заболевания в возрасте до 40 лет редки.
Частота миеломной болезни составляет 3 на 100000 населения в год; мужчины болеют несколько чаще.
Стадирование
Международная система стадирования
Международная система стадирования (International Scoring System — ISS) для миеломы была опубликована Международной рабочей группой по миеломе в 2005 году :
Стадия I:
- β2 микроглобулина (β2M)<3,5 мг/л, альбумина ≥ 3,5 г/дл
Стадия II:
- β2M <3,5 мг/л и альбумин<3,5 г/дл; или β2M 3,5-5,5 мг/л, независимо от сывороточного альбумина
Стадия III этап:
- β2M ≥ 5,5 мг/л
ISS должна использоваться только у больных, которые отвечают диагностическим критериям для симптоматической миеломы. Пациенты с MGUS и бессимптомной миеломой, которые имеют нарушение функции почек от прочих причин ( диабет , гипертония и т.д.), могут иметь повышенный уровень β2M в связи с почечной дисфункцией, и это не может служить доказательством стадии III миеломы. ISS скорее выполняет функцию прогностического индекса. По этой причине рекомендуется её использование наряду с Клинической классификацией ММ Дьюри-Салмона.
Клиническая классификация Дьюри-Салмона
Клиническая классификация ММ Дьюри-Салмона впервые была опубликована в 1975 году и используется до настоящего времени. Недостатком системы является субъективизм в определении степени поражения костей [ источник не указан 3370 дней ] .
-
Стадия I: обязательно наличие всех пунктов
- Hb> 100 г/л
- Нормальный уровень кальция крови
- Исследование скелета: норма или одиночная плазмоцитома или остеопороз
- Уровень парапротеина сыворотки <50 г/л, если IgG; или уровень парапротеина сыворотки <30 г/л, если IgA
- Мочевая экскреция легких цепей <4 г/24ч
- Стадия II: не соответствует критериям ни I, ни III
-
Стадия III: один или несколько пунктов
- Hb <85 г/л
- Высокое содержание кальция крови > 120 мг/л
- Исследование скелета: три или более литических костных поражения
- Парапротеин сыворотки >70 г/л, если IgG; или парапротеин сыворотки > 50 г/л, если IgA
- Мочевая экскреция легких цепей > 12 г/24ч
Стадии I, II, и III классификации Дьюри-Сальмона дополнительно подразделяют на A или B в зависимости от уровня креатинина :
- А: Креатинин сыворотки <20 мг/л (<177 мкмоль/л)
- B: Креатинин сыворотки> 20 мг/л (>177 мкмоль/л)
Классификация
Выделяют несколько вариантов миеломной болезни в зависимости от характера распространения миеломных инфильтратов в костном мозге, от характера миеломных клеток и от типа синтезируемого парапротеина.
-
по характеру распространённости опухолевого инфильтрата в
костном мозге
выделяют:
[
источник не указан 2966 дней
]
- диффузную,
- диффузно-очаговую,
- очаговую формы миеломы;
-
по клеточному составу:
- плазмоцитарную,
- плазмобластную,
- полиморфно-клеточную,
- мелкоклеточную миелому (по Струкову А. И.)
-
в зависимости от способности секретировать различные типы парапротеинов:
[
источник не указан 2966 дней
]
- несекретирующие,
- диклоновые миеломы,
- миелому Бенс-Джонса,
- G-, A-, M-миеломы.
Наиболее часто встречаются G-, A-миелома, миелома Бенс-Джонса, на долю которых приходится 75, 20 и 15 % наблюдений соответственно.
Морфология
Опухолевая ткань разрастается преимущественно в плоских костях (череп, рёбра, таз) и в позвоночнике , инициируя в них остеолизис и остеопороз . На рентгенограмме очаги поражения имеют вид гладкостенных пробоин. Полости образуются в местах роста миеломных клеток за счёт активации ими остеокластов, осуществляющих лизис и резорбцию костной ткани («пазушное» рассасывание). Помимо костного мозга, опухолевые инфильтраты могут обнаруживаться и в других органах [ источник не указан 2966 дней ] .
Клинические проявления

Множественная миелома может проявляться патологическими переломами, болями в костях, мягкотканными компонентами, анемическим синдромом, снижением гемоглобина, синдромом гипервязкости, тромбозами и кровотечениями. Вследствие разрушения костей в крови увеличивается количество кальция , который в виде конкрементов откладывается в выделительных органах ( почки , лёгкие , слизистая желудка ). Поражение почек (миеломная нефропатия) в основном обусловлено поступлением через почечный фильтр парапротеинов. Характерным для миеломной болезни является частота бактериальных инфекций вследствие уменьшения количества нормальных иммуноглобулинов и нарушения образования антител .
Лечение
Множественная миелома пока считается заболеванием неизлечимым, но хорошо контролируемым, при котором возможна продолжительная ремиссия . О потенциальном излечении можно говорить только в случаях успешной донорской трансплантации костного мозга .
Лечение множественной миеломы включает назначение химиопрепаратов и направлено на подавление клона опухолевых плазматических клеток с последующей симптомов болезни.
Химиотерапия — основной метод лечения. До середины XX века эффективных лекарственных средств не было, средняя продолжительность жизни составляла 17 месяцев. Успехи противоопухолевой терапии во второй половине XX века исторически связаны с разработкой алкилирующих агентов: с синтезом в России сарколизина и одновременно мелфалана — изомера сарколизина — в Англии в 1953 году, а также циклофосфана в 1958 году. Во-вторых, с трансплантацией гемопоэтических стволовых клеток (ТГСК). Химиотерапия мелфаланом и преднизолоном на протяжении 30 последующих лет оставалась стандартной терапией Множественной болезни, когда не может быть выполнена высокодозная химиотерапия/ ТГСК , медиана выживаемости — 3-3,5 года. С начала 70-х годов XX века применяется полихимиотерапия препаратами из разных химических групп (алкилирующие средства, кортикостероиды , антрациклины, винка-алкалоиды), эффективность её выше и составляет 60-70 %, но выживаемость больных существенно не улучшается.
В последнее десятилетие течение ММ заметно изменилось в связи с началом широкого использования наряду с химиопрепаратами новых классов антимиеломных лекарств:
- Иммуномодулирующие средства: леналидомид и помалидомид
- Ингибиторы протеасом: и (зарегистрирован в РФ 26.03.2016, регистрационный номер ЛП-003538 )
В случае бессимптомной = «тлеющей» миеломе (случаи, когда болезнь не проявляется в форме клинических симптомов (так как не поражены органы-мишени), но выявляются парапротеин и опухолевые плазматические клетки в костном мозге ) лечение, как правило, откладывается или ограничивается участием в клинических исследованиях .
В дополнение к препаратам, подавляющим пролиферацию клеток миеломы, применяют препараты поддерживающей терапии, например бисфосфонаты (памидронат или золедроновую кислоту ), останавливающие разрушение костной ткани , сопровождающее рост клеток миеломы в костном мозге, что предотвращает переломы . При необходимости коррекции анемии переливают эритроцитную массу или назначают эритропоэтин.
Методы лечения
Химиотерапия
Химиотерапия — основной метод лечения. До середины XX века эффективных лекарственных средств не было, средняя продолжительность жизни составляла 17 месяцев. Успехи противоопухолевой терапии во второй половине XX века исторически связаны с разработкой алкилирующих агентов: с синтезом в России сарколизина и одновременно мелфалана — изомера сарколизина — в Англии в 1953 году, а также циклофосфана в 1958 году. Во-вторых, с трансплантацией гемопоэтических стволовых клеток ( ТГСК ). Химиотерапия мелфаланом и преднизолоном на протяжении 30 последующих лет оставалась стандартной терапией Множественной болезни, когда не может быть выполнена высокодозная химиотерапия/ТГСК, медиана выживаемости — 3-3,5 года. С начала 70-х годов XX века применяется полихимиотерапия препаратами из разных химических групп (алкилирующие средства, кортикостероиды, антрациклины, винка-алкалоиды), эффективность её выше и составляет 60-70 %, но выживаемость больных существенно не улучшается. При ТГСК — полные ремиссии у 50 % первичных больных, медиана выживаемости — 4-5 лет, однако только 5 % пациентов трансплантируются (противопоказание — тяжелое соматическое состояние). Причина злокачественного течения ММ — развитие химиорезистентности, преодолеть которую можно с помощью лекарств с принципиально новыми механизмами действия — индуктор апоптоза (бортезомиб), противоопухолевыми иммуномодуляторами (леналидомид).
- Моно- и полихимиотерапия
-
- Мелфалан . Первое лекарственное средство для специфической терапии миеломы, внедрено в практику в 60-е г.г. прошлого века. До сих пор достаточно широко используется как в монотерапии, так и в комбинации с преднизолоном (МР), особенно для лечения пожилых больных. Ответ на терапию наблюдается не выше, чем у 50 % больных множественной миеломой.
-
- Циклофосфан . Чаще используется следующий режим: циклофосфамид по 400 мг через день или по 200 мг ежедневно или по 300 мг/м² раз в неделю до курсовой дозы 6-10 г — монотерапия или в комбинации с преднизолоном. Получены обнадеживающие результаты при использовании его комбинаций с инновационными препаратами (бортезомибом, леналидомидом) и стероидами.
-
- . Основной механизм действия — индукция апоптоза. Ответ наступает в 43 % случаев у пациентов с рецидивом миеломы, время до ответа около 2 месяцев, длительность ремиссии (время до прогрессии) — 7 месяцев, выживаемость — 29 месяцев. Используется как в монотерапии, так и в сочетании с другими препаратами: VMP — велкейд + мелфалан + преднизолон — зарегистрирован для лечение в первой линии терапии; VD — велкейд + дексаметазон для рецидивов болезни; PAD — велкейд + адриабластин + дексаметазон и другие. Его применение не исключает трансплантацию стволовых клеток. Вводится внутривенно, предпочтительно в стационарных условиях.
-
- Леналидомид . Имеет двойной механизм действия: активирует иммунные клетки организма, что приводит к гибели опухолевых клеток, и подавляет ангиогенез опухоли. При раннем использовании (вторая линия терапии) увеличивает ремиссию (время до прогрессии) до 17,1 месяцев, общую выживаемость — до 42 месяцев. Эффективен у 60 % пациентов. При длительном применении у пациентов, получивших ответ, общая выживаемость достигает 51 месяца (San Miguel, 2010). Применяется в комбинации со стероидным гормоном — дексаметазоном, а также алкилирующими агентами (циклофосфаном). Монотерапия леналидомидом рекомендована группой экспертов по миеломе NCCN в качестве поддерживающей терапии после ТСК. Имеет пероральную форму, удобен для амбулаторного приёма.
Программа ВАД (VAD):
| Препарат | Способ применения |
|---|---|
| винкристин | 0,4 мг/день 1-4 дня в виде постоянной в/в инфузии |
|
адриамицин
(доксорубицин) |
9 мг/м²/день 1-4 дня в виде постоянной в/в инфузии |
| дексаметазон | 40 мг/день per os или в/в дни 1-4, 9-12, 17-20 |
Программа M2 (VBMCP):
| Препарат | Способ применения |
|---|---|
| винкристин | 1,4 мг/м² в/в день 1-й |
| кармустин (BCNU) | 20 мг в/в день 1-й |
| мелфалан | 8 мг/м² per os дни 1-7 |
| циклофосфамид | 400 мг/м² в/в 1-й день |
| преднизолон | 40 мг/м² per os дни 1-7 |
-
- Препараты α- интерферона обычно применяют во время фазы плато ремиссий, достигнутых химиотерапией. Это достоверно увеличивает продолжительность ремиссий.
У больных молодого возраста при плохом прогнозе проводят высокодозную химиотерапию с последующей алло- и аутотрансплантацией красного костного мозга. Этот метод лечения увеличивает безрецидивную и общую выживаемость.
Симптоматическое лечение
Адекватная коррекция гиперкальциемии , использование анальгетиков, гемостатическая терапия, ортопедическая помощь.
Хирургическое лечение
Показано при солитарной миеломе, признаках сдавления жизненно важных органов.
Лучевая терапия
Показана как паллиативное лечение у ослабленных больных, при почечной недостаточности и резистентности опухоли к химиотерапии . Также возможно применение при локальных костных поражениях.
Тактика лечения
Начальная терапия
Начальное лечение множественной миеломы определяется возрастом пациента и наличием сопутствующих заболеваний. В последние годы для пациентов в возрасте до 65 лет и не имеющих тяжелой сопутствующей патологии предпочтительным методом лечения считается высокодозная химиотерапия ( мелфалан ) с трансплантацией аутологичных гемопоэтических стволовых клеток . Эти пациенты на этапе подготовки к высокодозной химиотерапии получают сначала индукционные курсы стандартной химиотерапии. Наиболее распространенные схемы индукционной химиотерапии разработаны на основе и леналидомида (бортезомиб/ циклофосфан / дексаметазон и леналидомид/дексаметазон) .
Трансплантация аутологичных (собственных стволовых клеток пациента) стволовых клеток является наиболее распространенным вариантом трансплантации для множественной миеломы. Эта процедура дает возможность многократно повысить дозы цитостатиков (мелфалан), что позволяет закрепить эффект индукционной химиотерапии, увеличить продолжительность полной ремиссии и продлить общую выживаемость. В 2023 г. был одобрен .
Трансплантация аллогенных стволовых клеток — трансплантация стволовых клеток здорового донора пациенту с ММ, позволяет в ряде случаев полностью излечить заболевание, но используется у небольшой части молодых пациентов (как правило, при рецидивах ) , что связано с высокой смертностью (5-10 %) в результате токсического действия самого лечения.
Пациенты старше 65 лет и пациенты, имеющие тяжелые сопутствующие заболевания, зачастую не могут перенести высокодозную химиотерапию с трансплантацией аутологичных стволовых клеток. Для таких больных долгие годы стандартом лечения оставалась комбинация низких доз мелфалана и преднизолона . Добавление к этой комбинации бортезомиба улучшило долговременные результаты лечения . В сравнительном исследовании общая выживаемость в группе бортезомиба на 30 месяцев составила 83 % (почти на 15 % выше, чем в группе без бортезомиба). Использование комбинаций на основе леналидомида также улучшает долговременные результаты лечения в группе пациентов с ММ, которым не показана высокодозная химиотерапия . Применение комбинации леналидомида с низкими дозами дексаметазона позволило добиться 2-х летней общей выживаемости в 82 %, а при использовании комбинации мелфалана, преднизолона и леналидомида эта величина составила 90 %. Непосредственно между собой режимы на основе бортезомиба и леналидомида не сравнивались .
Поддерживающая терапия
У больных, получивших высокодозную химиотерапию с трансплантацией аутологичных стволовых клеток , может использоваться длительная поддерживающая терапия леналидомидом , талидомидом или . Применение леналидомида в двух крупных исследованиях было связано с увеличением длительности медианы времени до прогрессирования по сравнению с плацебо — 46 против 27 месяцев (р <0,0001) и 41 против 23 месяцев соответственно леналидомид и плацебо (р <0,001).
Лечение рецидивов и резистентных форм
Рецидивы после лечения возникают практически у всех пациентов, наблюдающихся достаточно долго. Это может быть связано с гетерогенностью состава опухоли .
В зависимости от состояния пациента, длительности ремиссии и использованных ранее методов лечения, возможные варианты терапии рецидивирующей миеломы включают:
- использование препаратов с иным механизмом действия (к примеру, если в первой линии использовался ингибитор протеосом — , то во второй линии более эффективно будет работать иммуномодулятор леналидомид ),
- повторное назначение начальной терапии первой линии,
- применение новых препаратов с большей активностью в отношении резистентных (к существующим лекарственным средствам) клеток миеломы ( помалидомид (в комбинации с дексаметазоном показан для лечения взрослых больных с рецидивирующей и рефрактерной множественной миеломой, которые получили не менее двух предшествующих режимов лечения, включающих и леналидомид, и бортезомиб, и у которых отмечалось прогрессирование заболевания во время последней терапии) и карфилзомиб). Другие препараты: , .
- Моноклональные антитела : даратумумаб , элотузумаб , изатуксимаб , белантамаб мафодотин , , , .
- Генная терапия : , .
Также может быть проведена и повторная трансплантация аутологичных или аллогенных стволовых клеток.
Для пациентов с рецидивами ММ, не получавшими в первой линии , включение этого препарата в режимы второй линии позволяет значительно увеличить результативность лечения . Аналогичным образом применение леналидомида у пациентов с рецидивами или резистентным течением ММ увеличивает общую и безрецидивную выживаемость . Для больных, не ответивших на эти препараты, прогноз значительно хуже и в этих случаях рассматриваются возможности назначения иммуномодулятора третьего поколения — помалидомида и нового ингибитора протеосом — карфилзомиба.
Клеточная терапия для рецидивов и резистентных форм миеломной болезни
С учётом неизбежности развития рецидива множественной миеломы, а также приобретения клетками опухоли устойчивости к лекарственной терапии, все больше внимания стали привлекать возможности клеточной терапии, а именно, CAR-T терапии ( ).
Принцип применения CAR-T (Т-лимфоцитов с химерным антигенным рецептором) основан на изменении активности собственной иммунной системы заболевшего в сторону клеток опухоли.
На поверхности опухолевых клеток миеломной болезни присутствует белок BCMA, который несвойственен здоровым клеткам организма. Т-лимфоциты — клетки иммунной системы, способные уничтожать чужеродные агенты. У пациента осуществляется забор Т-лимфоцитов (из периферической вены), в лабораторных условиях к ним присоединяют анти-BCMA CAR-рецептор, который позволит распознать и уничтожить клетки опухоли, на поверхности которых присутствует белок BCMA. Далее пациенту переливают его собственные, но уже модифицированные, Т-лимфоциты, тем самым обеспечивая иммунную атаку на существующую опухоль.
CAR-T терапия имеет широкое применение при B-клеточных лимфомах/лейкозах, принципы, осложнения и методы их коррекции хорошо изучены и управляемы. Самым распространённым осложнением является токсичность на нервную систему и развитие цитокинового шторма — выброса медиаторов воспаления в кровь, приводящего к таким симптомам, как повышение температуры тела, озноб, падение артериального давления, учащение сердцебиения и дыхания, снижение насыщения кислородом крови. Однако, побочные эффекты хорошо поддаются лечению и при условии наблюдения пациента в специализированном стационаре не представляют угрозы для жизни пациента (по статистике только 3 % пациентов погибает от осложнений CAR-T терапии).
Первые положительные результаты применения CAR-T терапии в отношении миеломной болезни были опубликованы в 2019 году. Тогда в американское исследование вошли 33 пациента с рецидивом множественной миеломы или рефрактерным (нечувствительным к лечению) течением болезни, получивших 3 линии терапии. В рамках клинического исследования пациенты получили введение анти-BCMACAR-T клеток, токсичность проведенного лечения оказалась приемлемой, а 85 % пациентов достигли полного эффекта (ремиссии) при сроке наблюдения 11 месяцев .
Характеристика препаратов
Мелфалан
Первое лекарственное средство для специфической терапии миеломы, внедрено в практику в 60-е г.г. прошлого века. До сих пор достаточно широко используется как в монотерапии, так и в комбинации с преднизолоном (МР), особенно для лечения пожилых больных. Ответ на терапию наблюдается не выше, чем у 50 % больных множественной миеломой.
Циклофосфан
Чаще используется следующий режим: циклофосфамид по 400 мг через день или по 200 мг ежедневно или по 300 мг/м² раз в неделю до курсовой дозы 6-10 г — монотерапия или в комбинации с преднизолоном. Получены обнадеживающие результаты при использовании его комбинаций с инновационными препаратами ( , леналидомидом) и стероидами.
Бортезомиб
Бортезомиб является обратимым ингибитором протеасом с выраженным эффектом в отношении клеток миеломы , он ингибирует активность остеокластов и способствует дифференциации и пролиферации остеобластов, что препятствует костному разрушению .
Токсичность бортезомиба
- Наиболее распространенные побочные эффекты бортезомиба: периферическая нейропатия, тромбоцитопения, желудочно-кишечные симптомы, реактивация вируса опоясывающего герпеса.
- В исследованиях нейропатия, включая сенсорную и обострение периферической нейропатии (ПН), отмечалась в 37 % случаев; при чем ПН 3 степени — у 14 %. ПН явилась причиной отмены препарата в 6 % случаев. Показано, что бортезомибная ПН является кумулятивной, в ряде случаев может быть обратимой при прекращении терапии или модификации дозы .
- Подкожное введение бортезомиба (утверждено как равно эффективное федеральным агентством надзора за лекарственными препаратами США — FDA ) связано с меньшей частотой ПН .
- Редкие легочные побочные эффекты бортезомиба контролируются назначением высоких доз стероидов и прекращением лечения
Леналидомид
Леналидомид, иммуномодулятор , проявляет выраженную активность против клеток миеломы путём увеличения активности натуральных киллеров за счет регуляции продукции интерферона гамма-1b и IL-2, а также за счет ингибирование ангиогенеза , индукции апоптоза и нарушения контакта клеток миеломы со стромальными клетками костного мозга . Кроме того, леналидомид является мощным ингибитором остеокластогенеза, препятствуя костной деструкции
Токсичность леналидомида
- Леналидомид может вызывать миелосупрессию , в комбинации с дексаметазоном повышает риск тромбозов , около у 30 % пациентов, получающих леналидомид, отмечают возникновение кожной сыпи
- Редкие встречается гепатотоксичность , аллергический пневмонит и прогрессивную азотемию у пациентов с существовавшей ранее почечной дисфункцией
- Воздействие леналидомида несколько ухудшает результаты сбора стволовых клеток, но в подавляющем большинстве случаев это не препятствует проведению аутологичной трансплантации
Имеющиеся данные о повышении частоты вторых первичных опухолей на фоне длительного комбинированного применения леналидомида с мелфаланом были тщательно изучены. 13.01.12 г. получено решение комиссии Европейского Медицинского Агентства, указывающее, что соотношение пользы и риска, при условии применения леналидомида по одобренным показаниям, осталось благоприятным. В дальнейшем, показано, что при вторых гемобластозах наиболее вероятна их связь не с терапией леналидомидом, а с терапией алкилирующими химиопрепаратами . Это согласуется с ранее полученными результатами, в которых отмечался лейкозогенный потенциал мелфалана.
Помалидомид
- Помалидомид является пероральным иммуномодулирующим препаратом 3 поколения.
- Помалидомид вызывает остановку клеточного цикла миеломных клеток , блокирует ангиогенез и ингибирует взаимодействие между клетками миеломы и их микроокружением .
- Наиболее распространенные побочные эффекты связанные с применением помалидомида включают усталость и астению , нейтропению, анемию , запоры, тошноту , диарею , инфекции верхних дыхательных путей, боли в спине, и гипертермию
Схемы на основе помалидомида
Помалидомид одобрен в США и ЕС для лечения пациентов с рецидивирующим/ рефрактерным течением множественной миеломы, получавших бортезомиб и леналидомид и отметивших раннюю (в течение 60 дней после окончания курса) прогрессию опухоли.
В международном многоцентровом рандомизированном исследовании III фазы (MM-003) помалидомид (в комбинации с низкими дозами дексаметазона) сравнивался со стандартной терапией высокодозным дексаметазоном у пациентов с ранним рецидивом ММ, которые получили терапию и бортезомибом, и леналидомидом.
Было показано, что помалидомид снижает уровень прогрессии на 52 % (PFS 4.0 vs 1.9 мес.) и значимо увеличивает общую продолжительность жизни (12.7 vs 8.1 мес.), различия статистически достверны (P≤0.001) (медиана наблюдения 10 мес) .
Общая частота ответа и 12-месячная выживаемость без прогрессирования были сходны у больных, получавших помалидомид в дозе 4 мг в дни 1-21 (28-дневного цикла) против получавших непрерывно 4 мг в дни 1-28 (28-дневного цикла). Однако к 18-месяцам наблюдения в целом эффект был несколько выше в группе получаших помалидомид 21 день с 7 дневным перерывом .
Карфилзомиб
Карфилзомиб, в отличие от бортезомиба, является необратимым ингибитором протеасом, имеющий значительные структурные отличия от этого препарата . Карфилзомиб является более избирательным в отношении химотрипсинподобных протеаз и проявляет большую надежность и селективность при ингибировании активности протеасом по сравнению с бортезомибом .
Карфилзомиб-ассоциированная токсичность
- Профиль безопасности карфилзомиба отличается от такового бортезомиба в сторону меньшей частоты и выраженности периферических нейропатий
- Наиболее распространенными неблагоприятными эффектами карфилзомиба более ≥ 3 степени тяжести выявленные в клинических исследованиях II фазы были тромбоцитопения , анемия , лимфопения, пневмония , и нейтропения
Схемы на основе Карфилзомиба
Карфилзомиб одобрен для лечения пациентов с множественной миеломой, получивших, по крайней мере, 2 схемы лечения, в том числе с бортезомибом и иммуномодулирующими агентами (леналидомид, талидомид ), и отметивших прогрессию опухоли в течение 60 дней после завершения лечения .
В исследовании II фазы (003-A1) карфилозомиб изучался у 226 пациентов с рецидивирующей и рефрактерной миеломой. Было показано, что монотерапия карфилозомибом имеет клинический эффект у 36 % пациентов, медиана ответа составляет 7,8 месяцев. На основании результатов этого исследования карфилозомиб был одобрен FDA к применению в США .
В дальнейшем изучались комбинированные режимы терапии карфилозомибом с целью поиска наиболее эффективных схем.
Карфилзомиб в сочетании с леналидомидом и низкими дозами дексаметазона показал частоту ответа у 78 % у пациентов с резистентными рецидивами ММ .
Карфилзомиб оказался эффективным и у больных, ранее получавших бортезомиб, в том числе с неблагоприятными цитогенетическими поломками .
Литература
- Патологическая анатомия. Курс лекций. Под ред. В. В. Серова, М. А. Пальцева. — М.: Медицина, 1998
- Внутренние болезни. В двух томах. Под. ред. А. И. Мартынова, Н. А. Мухина, В. С. Моисеева. — ГЭОТАР-МЕД, 2001
См. также
- Гемобластозы
- Лейкозы
- Хронические лейкозы
- Хронические лимфоцитарные лейкозы
- Парапротеинемические лейкозы
Ссылки
Примечания
- (англ.) — 2016.
- International Myeloma Working Group. (англ.) // British Journal Of Haematology. — 2003. — June ( vol. 121 , no. 5 ). — P. 749—757 . — .
- Kyle R. A. , Rajkumar S. V. (англ.) // Leukemia. — 2009. — January ( vol. 23 , no. 1 ). — P. 3—9 . — doi : . — .
- ↑ Greipp P. R. , San Miguel J. , Durie B. G. , Crowley J. J. , Barlogie B. , Bladé J. , Boccadoro M. , Child J. A. , Avet-Loiseau H. , Kyle R. A. , Lahuerta J. J. , Ludwig H. , Morgan G. , Powles R. , Shimizu K. , Shustik C. , Sonneveld P. , Tosi P. , Turesson I. , Westin J. (англ.) // Journal Of Clinical Oncology : Official Journal Of The American Society Of Clinical Oncology. — 2005. — 20 May ( vol. 23 , no. 15 ). — P. 3412—3420 . — doi : . — .
- Durie B. G. , Salmon S. E. (англ.) // Cancer. — 1975. — September ( vol. 36 , no. 3 ). — P. 842—854 . — doi : . — .
- Остеолизис — разрушение костной ткани
- . grls.rosminzdrav.ru. Дата обращения: 21 октября 2016. 22 октября 2016 года.
- Korde N. , Kristinsson S. Y. , Landgren O. (англ.) // Blood. — 2011. — 26 May ( vol. 117 , no. 21 ). — P. 5573—5581 . — doi : . — .
- Сарколизин является производным бис-(b-хлорэтил)-амина и аминокислоты фенилаланина
- Munshi N. C. (англ.) // Hematology. American Society Of Hematology. Education Program. — 2008. — P. 297—297 . — doi : . — .
- Raab M. S. , Podar K. , Breitkreutz I. , Richardson P. G. , Anderson K. C. (англ.) // Lancet (London, England). — 2009. — 25 July ( vol. 374 , no. 9686 ). — P. 324—339 . — doi : . — .
- Davies F. E. , Wu P. , Jenner M. , Srikanth M. , Saso R. , Morgan G. J. (англ.) // Haematologica. — 2007. — August ( vol. 92 , no. 8 ). — P. 1149—1150 . — doi : . — .
- Palumbo A., et al., A phase 3 study to determine the efficacy and safety of Lenalidomide combined with melphalane and prednisone in patients = 65 years with newly diagnosed multiple myeloma (NDMM), EHA, 2010, abstract 0566
- Glickman M. H. , Ciechanover A. (англ.) // Physiological Reviews. — 2002. — April ( vol. 82 , no. 2 ). — P. 373—428 . — doi : . — .
- Richardson P. G. , Sonneveld P. , Schuster M. , Irwin D. , Stadtmauer E. , Facon T. , Harousseau J. L. , Ben-Yehuda D. , Lonial S. , Goldschmidt H. , Reece D. , Miguel J. S. , Bladé J. , Boccadoro M. , Cavenagh J. , Alsina M. , Rajkumar S. V. , Lacy M. , Jakubowiak A. , Dalton W. , Boral A. , Esseltine D. L. , Schenkein D. , Anderson K. C. (англ.) // Blood. — 2007. — 15 November ( vol. 110 , no. 10 ). — P. 3557—3560 . — doi : . — .
- Stadtmauer E. A. , Weber D. M. , Niesvizky R. , Belch A. , Prince M. H. , San Miguel J. F. , Facon T. , Olesnyckyj M. , Yu Z. , Zeldis J. B. , Knight R. D. , Dimopoulos M. A. (англ.) // European Journal Of Haematology. — 2009. — June ( vol. 82 , no. 6 ). — P. 426—432 . — doi : . — .
- Kyle R. A. , Rajkumar S. V. (англ.) // Blood. — 2008. — 15 March ( vol. 111 , no. 6 ). — P. 2962—2972 . — doi : . — .
- Kyle R. A. , Rajkumar S. V. (англ.) // The New England Journal Of Medicine. — 2004. — 28 October ( vol. 351 , no. 18 ). — P. 1860—1873 . — doi : . — .
- Curran M. P. , McKeage K. (англ.) // Drugs. — 2009. — Vol. 69 , no. 7 . — P. 859—888 . — doi : . — .
- Durie B. G. (англ.) // The New England Journal Of Medicine. — 2008. — 28 August ( vol. 359 , no. 9 ). — P. 964—966 . — doi : . — .
- ↑ Richardson P. G. , Barlogie B. , Berenson J. , Singhal S. , Jagannath S. , Irwin D. , Rajkumar S. V. , Srkalovic G. , Alsina M. , Alexanian R. , Siegel D. , Orlowski R. Z. , Kuter D. , Limentani S. A. , Lee S. , Hideshima T. , Esseltine D. L. , Kauffman M. , Adams J. , Schenkein D. P. , Anderson K. C. (англ.) // The New England Journal Of Medicine. — 2003. — 26 June ( vol. 348 , no. 26 ). — P. 2609—2617 . — doi : . — .
- ↑ Weber D. M. , Chen C. , Niesvizky R. , Wang M. , Belch A. , Stadtmauer E. A. , Siegel D. , Borrello I. , Rajkumar S. V. , Chanan-Khan A. A. , Lonial S. , Yu Z. , Patin J. , Olesnyckyj M. , Zeldis J. B. , Knight R. D. , Multiple Myeloma (009) Study Investigators. (англ.) // The New England Journal Of Medicine. — 2007. — 22 November ( vol. 357 , no. 21 ). — P. 2133—2142 . — doi : . — .
- Raje N. , Berdeja J. , Lin Y. , Siegel D. , Jagannath S. , Madduri D. , Liedtke M. , Rosenblatt J. , Maus M. V. , Turka A. , Lam L. P. , Morgan R. A. , Friedman K. , Massaro M. , Wang J. , Russotti G. , Yang Z. , Campbell T. , Hege K. , Petrocca F. , Quigley M. T. , Munshi N. , Kochenderfer J. N. (англ.) // The New England Journal Of Medicine. — 2019. — 2 May ( vol. 380 , no. 18 ). — P. 1726—1737 . — doi : . — .
- Хидешима 2001b; Хидешима 2002;Mitsiades 2003; Хидешима 2003a; Хидешима 2003b
- фон Metzler 2007; Мукерджи 2008
- Richardson P. G. , Briemberg H. , Jagannath S. , Wen P. Y. , Barlogie B. , Berenson J. , Singhal S. , Siegel D. S. , Irwin D. , Schuster M. , Srkalovic G. , Alexanian R. , Rajkumar S. V. , Limentani S. , Alsina M. , Orlowski R. Z. , Najarian K. , Esseltine D. , Anderson K. C. , Amato A. A. (англ.) // Journal Of Clinical Oncology : Official Journal Of The American Society Of Clinical Oncology. — 2006. — 1 July ( vol. 24 , no. 19 ). — P. 3113—3120 . — doi : . — .
- Badros A. , Goloubeva O. , Dalal J. S. , Can I. , Thompson J. , Rapoport A. P. , Heyman M. , Akpek G. , Fenton R. G. (англ.) // Cancer. — 2007. — 1 September ( vol. 110 , no. 5 ). — P. 1042—1049 . — doi : . — .
- Richardson P. G. , Xie W. , Mitsiades C. , Chanan-Khan A. A. , Lonial S. , Hassoun H. , Avigan D. E. , Oaklander A. L. , Kuter D. J. , Wen P. Y. , Kesari S. , Briemberg H. R. , Schlossman R. L. , Munshi N. C. , Heffner L. T. , Doss D. , Esseltine D. L. , Weller E. , Anderson K. C. , Amato A. A. (англ.) // Journal Of Clinical Oncology : Official Journal Of The American Society Of Clinical Oncology. — 2009. — 20 July ( vol. 27 , no. 21 ). — P. 3518—3525 . — doi : . — .
- Moreau Philippe , Pylypenko Halyna V , Grosicki Sebastian , Karamanesht Evgeniy E , Leleu Xavier , Grishunina Maria E , Rekhtman Grigoriy B , Masliak Zvenyslava , Robak Tadeusz , Shubina Anna V , Fermand Jean-Paul , Kropff Martin , Cavet James , Parasuraman Sudha , Feng Huaibao , Skee Donna M , van de Velde Helgi , Deraedt William M , Harousseau Jean-Luc. (англ.) // Blood. — 2010. — 19 November ( vol. 116 , no. 21 ). — P. 312—312 . — ISSN . — doi : .
- Zappasodi P. , Dore R. , Castagnola C. , Astori C. , Varettoni M. , Mangiacavalli S. , Lazzarino M. , Corso A. (англ.) // Journal Of Clinical Oncology : Official Journal Of The American Society Of Clinical Oncology. — 2007. — 1 August ( vol. 25 , no. 22 ). — P. 3380—3381 . — doi : . — .
- Duek A. , Feldberg E. , Haran M. , Berrebi A. (англ.) // American Journal Of Hematology. — 2007. — June ( vol. 82 , no. 6 ). — P. 502—503 . — doi : . — .
- Miyakoshi S. , Kami M. , Yuji K. , Matsumura T. , Takatoku M. , Sasaki M. , Narimatsu H. , Fujii T. , Kawabata M. , Taniguchi S. , Ozawa K. , Oshimi K. (англ.) // Blood. — 2006. — 1 May ( vol. 107 , no. 9 ). — P. 3492—3494 . — doi : . — .
- Davies F. E. , Raje N. , Hideshima T. , Lentzsch S. , Young G. , Tai Y. T. , Lin B. , Podar K. , Gupta D. , Chauhan D. , Treon S. P. , Richardson P. G. , Schlossman R. L. , Morgan G. J. , Muller G. W. , Stirling D. I. , Anderson K. C. (англ.) // Blood. — 2001. — 1 July ( vol. 98 , no. 1 ). — P. 210—216 . — doi : . — .
- Mitsiades N. , Mitsiades C. S. , Poulaki V. , Chauhan D. , Richardson P. G. , Hideshima T. , Munshi N. C. , Treon S. P. , Anderson K. C. (англ.) // Blood. — 2002. — 15 June ( vol. 99 , no. 12 ). — P. 4525—4530 . — doi : . — .
- Chang D. H. , Liu N. , Klimek V. , Hassoun H. , Mazumder A. , Nimer S. D. , Jagannath S. , Dhodapkar M. V. (англ.) // Blood. — 2006. — 15 July ( vol. 108 , no. 2 ). — P. 618—621 . — doi : . — .
- Dredge K. , Horsfall R. , Robinson S. P. , Zhang L. H. , Lu L. , Tang Y. , Shirley M. A. , Muller G. , Schafer P. , Stirling D. , Dalgleish A. G. , Bartlett J. B. (англ.) // Microvascular Research. — 2005. — January ( vol. 69 , no. 1-2 ). — P. 56—63 . — doi : . — .
- ↑ Breitkreutz I. , Raab M. S. , Vallet S. , Hideshima T. , Raje N. , Mitsiades C. , Chauhan D. , Okawa Y. , Munshi N. C. , Richardson P. G. , Anderson K. C. (англ.) // Leukemia. — 2008. — October ( vol. 22 , no. 10 ). — P. 1925—1932 . — doi : . — .
- Dimopoulos M. , Spencer A. , Attal M. , Prince H. M. , Harousseau J. L. , Dmoszynska A. , San Miguel J. , Hellmann A. , Facon T. , Foà R. , Corso A. , Masliak Z. , Olesnyckyj M. , Yu Z. , Patin J. , Zeldis J. B. , Knight R. D. , Multiple Myeloma (010) Study Investigators. (англ.) // The New England Journal Of Medicine. — 2007. — 22 November ( vol. 357 , no. 21 ). — P. 2123—2132 . — doi : . — .
- Sviggum H. P. , Davis M. D. , Rajkumar S. V. , Dispenzieri A. (англ.) // Archives Of Dermatology. — 2006. — October ( vol. 142 , no. 10 ). — P. 1298—1302 . — doi : . — .
- Hussain S. , Browne R. , Chen J. , Parekh S. (англ.) // Blood. — 2007. — 15 November ( vol. 110 , no. 10 ). — P. 3814—3814 . — doi : . — .
- Thornburg A. , Abonour R. , Smith P. , Knox K. , Twigg HL 3rd. (англ.) // Chest. — 2007. — May ( vol. 131 , no. 5 ). — P. 1572—1574 . — doi : . — .
- Batts E. D. , Sanchorawala V. , Hegerfeldt Y. , Lazarus H. M. (англ.) // Leukemia & Lymphoma. — 2008. — June ( vol. 49 , no. 6 ). — P. 1108—1115 . — doi : . — .
- [Кумар 2007; Mazumder 2008 ; Paripati 2008]
- Facon Thierry , Dimopoulos Meletios A. , Dispenzieri Angela , Catalano John V. , Belch Andrew R , Hulin Cyrille , Cavo Michele , Pinto Antonella , Weisel Katja , Ludwig Heinz , Bahlis Nizar J. , Banos Anne , Tiab Mourad , Delforge Michel , Cavenagh James D , Geraldes Catarina , Lee Je-Jung , Chen Christine I. , Oriol Albert , De La Rubia Javier , Qiu Lugui , White Darrell J. , Binder Daniel , Anderson Kenneth C. , Moreau Philippe , Attal Michel , Knight Robert , Chen Guang , Van Oostendorp Jason , Jacques Christian J. , Ervin-Haynes Annette , Benboubker Lofti. (англ.) // Blood. — 2013. — 15 November ( vol. 122 , no. 21 ). — P. 2—2 . — ISSN . — doi : .
- Escoubet-Lozach L. , Lin I. L. , Jensen-Pergakes K. , Brady H. A. , Gandhi A. K. , Schafer P. H. , Muller G. W. , Worland P. J. , Chan K. W. , Verhelle D. (англ.) // Cancer Research. — 2009. — 15 September ( vol. 69 , no. 18 ). — P. 7347—7356 . — doi : . — .
- Hideshima T. , Chauhan D. , Shima Y. , Raje N. , Davies F. E. , Tai Y. T. , Treon S. P. , Lin B. , Schlossman R. L. , Richardson P. , Muller G. , Stirling D. I. , Anderson K. C. (англ.) // Blood. — 2000. — 1 November ( vol. 96 , no. 9 ). — P. 2943—2950 . — .
- US Food and Drug Administration. . Дата обращения: 18 ноября 2014. 15 ноября 2014 года.
- U.S. Food and Drug Administration. POMALYST (pomalidomide). Approved Drugs. Available from (accessed December 2013). European Medicines Agency. Imnovid (pomalidomide). Summary of product characteristics. Available from (accessed August 2013). .
- [Dimopoulos 2012]
- Leleu X. , Attal M. , Arnulf B. , Moreau P. , Traulle C. , Marit G. , Mathiot C. , Petillon M. O. , Macro M. , Roussel M. , Pegourie B. , Kolb B. , Stoppa A. M. , Hennache B. , Bréchignac S. , Meuleman N. , Thielemans B. , Garderet L. , Royer B. , Hulin C. , Benboubker L. , Decaux O. , Escoffre-Barbe M. , Michallet M. , Caillot D. , Fermand J. P. , Avet-Loiseau H. , Facon T. , Intergroupe Francophone du Myélome. (англ.) // Blood. — 2013. — 14 March ( vol. 121 , no. 11 ). — P. 1968—1975 . — doi : . — .
- Demo S. D. , Kirk C. J. , Aujay M. A. , Buchholz T. J. , Dajee M. , Ho M. N. , Jiang J. , Laidig G. J. , Lewis E. R. , Parlati F. , Shenk K. D. , Smyth M. S. , Sun C. M. , Vallone M. K. , Woo T. M. , Molineaux C. J. , Bennett M. K. (англ.) // Cancer Research. — 2007. — 1 July ( vol. 67 , no. 13 ). — P. 6383—6391 . — doi : . — .
- Jain S. , Diefenbach C. , Zain J. , O'Connor O. A. (англ.) // Core Evidence. — 2011. — Vol. 6 . — P. 43—57 . — doi : . — .
- ↑ Singhal Seema , Siegel David S. , Martin Thomas , Vij Ravi , Wang Luhua , Jakubowiak Andrzej J , Lonial Sagar , Kukreti Vishal , Zonder Jeffrey A. , Wong Alvin F. , McCulloch Leanne , Badros Ashraf Z. , Niesvizky Ruben , Orlowski Robert Z. , Stewart A. Keith , Kotlovker Debbi , Jagannath Sundar. (англ.) // Blood. — 2011. — 18 November ( vol. 118 , no. 21 ). — P. 1876—1876 . — ISSN . — doi : .
- Vij Ravi , Richardson Paul Gerard Guy , Jagannath Sundar , Siegel David Samuel DiCapua , Baz Rachid C. , Srinivasan Shankar , Larkins Gail , Zaki Mohamed H. , Hussein Mohamad A. , Anderson Kenneth Carl. (англ.) // Journal of Clinical Oncology. — 2012. — 20 May ( vol. 30 , no. 15_suppl ). — P. 8016—8016 . — ISSN . — doi : .
- " "Carfilzomib Prescribing Information", NCI Drug Dictionary. Retrieved 2013-07-23".
- Niesvizky Ruben , Wang Luhua , Orlowski Robert Z , Bensinger William , Alsina Melissa , Gabrail Nashat , Gutierrez Andres , Kunkel Lori , Kauffman Michael , The Multiple Myeloma Research Consortium (MMRC). (англ.) // Blood. — 2009. — 20 November ( vol. 114 , no. 22 ). — P. 304—304 . — ISSN . — doi : .
- Vij R. , Siegel D. S. , Kaufman J. L. , Jakubowiak A. J. , Stewart A. K. , Jagannath S. , Kukreti V. , Le M. H. , Bennett M. K. , Wang M. , The Multiple Myeloma Research Consortium. (англ.) // Journal of Clinical Oncology. — 2010. — 20 May ( vol. 28 , no. 15_suppl ). — P. 8000—8000 . — ISSN . — doi : .
- Jakubowiak A. J. , Siegel D. S. , Martin T. , Wang M. , Vij R. , Lonial S. , Trudel S. , Kukreti V. , Bahlis N. , Alsina M. , Chanan-Khan A. , Buadi F. , Reu F. J. , Somlo G. , Zonder J. , Song K. , Stewart A. K. , Stadtmauer E. , Harrison B. L. , Wong A. F. , Orlowski R. Z. , Jagannath S. (англ.) // Leukemia. — 2013. — December ( vol. 27 , no. 12 ). — P. 2351—2356 . — doi : . — .
- 2021-06-05
- 1