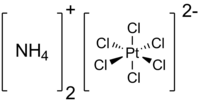
Гексахлороплатинат(IV) аммония
— неорганическое соединение, комплексное соединение металла
платины
с формулой (NH
4
)
2
[PtCl
6
], светло-жёлтые кристаллы, плохо растворяется в воде.
Получение
P
t
C
l
4
+
2
N
H
4
C
l
→
(
N
H
4
)
2
[
P
t
C
l
6
]
{\displaystyle {\mathsf {PtCl_{4}+2NH_{4}Cl\ {\xrightarrow {}}\ (NH_{4})_{2}[PtCl_{6}]}}}
H
2
[
P
t
C
l
6
]
+
2
N
H
4
C
l
→
(
N
H
4
)
2
[
P
t
C
l
6
]
↓
+
2
H
C
l
{\displaystyle {\mathsf {H_{2}[PtCl_{6}]+2NH_{4}Cl\ {\xrightarrow {}}\ (NH_{4})_{2}[PtCl_{6}]\downarrow +2HCl}}}
Физические свойства
Гексахлороплатинат(IV) аммония образует светло-жёлтые кристаллы
кубической сингонии
,
пространственная группа
F m3m
, параметры ячейки
a
= 0,9854 нм.
Плохо растворяется в холодной воде.
Химические свойства
Разлагается при нагревании:
(
N
H
4
)
2
[
P
t
C
l
6
]
→
215
−
350
o
C
P
t
+
2
N
H
4
C
l
+
2
C
l
2
↑
{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]\ \xrightarrow {215-350^{o}C} \ Pt+2NH_{4}Cl+2Cl_{2}\uparrow }}}
3
(
N
H
4
)
2
[
P
t
C
l
6
]
→
350
−
600
o
C
3
P
t
+
2
N
H
3
↑
+
18
H
C
l
↑
+
2
N
2
↑
{\displaystyle {\mathsf {3(NH_{4})_{2}[PtCl_{6}]\ \xrightarrow {350-600^{o}C} \ 3Pt+2NH_{3}\uparrow +18HCl\uparrow +2N_{2}\uparrow }}}
(
N
H
4
)
2
[
P
t
C
l
6
]
+
4
N
a
O
H
→
P
t
O
2
↓
+
6
N
H
4
C
l
+
4
N
a
C
l
+
2
H
2
O
{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+4NaOH\ {\xrightarrow {}}\ PtO_{2}\downarrow +6NH_{4}Cl+4NaCl+2H_{2}O}}}
Реагирует с концентрированными
щелочами
:
(
N
H
4
)
2
[
P
t
C
l
6
]
+
2
N
a
O
H
→
100
o
C
(
N
H
4
)
2
[
P
t
(
O
H
)
6
]
↓
+
6
N
a
C
l
{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+2NaOH\ {\xrightarrow {100^{o}C}}\ (NH_{4})_{2}[Pt(OH)_{6}]\downarrow +6NaCl}}}
С концентрированным раствором
аммиака
реакция идёт иначе:
(
N
H
4
)
2
[
P
t
C
l
6
]
+
2
(
N
H
3
⋅
H
2
O
)
→
[
P
t
(
N
H
3
)
2
C
l
4
]
↓
+
2
N
H
4
C
l
+
2
H
2
O
{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+2(NH_{3}\cdot H_{2}O)\ {\xrightarrow {}}\ [Pt(NH_{3})_{2}Cl_{4}]\downarrow +2NH_{4}Cl+2H_{2}O}}}
(
N
H
4
)
2
[
P
t
C
l
6
]
+
2
H
2
S
→
P
t
S
2
↓
+
2
N
H
4
C
l
+
4
H
C
l
{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+2H_{2}S\ {\xrightarrow {}}\ PtS_{2}\downarrow +2NH_{4}Cl+4HCl}}}
(
N
H
4
)
2
[
P
t
C
l
6
]
+
2
H
C
O
O
H
→
τ
P
t
↓
+
2
C
O
2
↑
+
2
N
H
4
C
l
+
4
H
C
l
{\displaystyle {\mathsf {(NH_{4})_{2}[PtCl_{6}]+2HCOOH\ {\xrightarrow {\tau }}\ Pt\downarrow +2CO_{2}\uparrow +2NH_{4}Cl+4HCl}}}
Литература
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. —
М.
: Советская энциклопедия, 1992. — Т. 3. — 639 с. —
ISBN 5-82270-039-8
.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. —
М.
—
Л.
: Химия, 1966. — Т. 1. — 1072 с.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. —
Л.
: Химия, 1971. — Т. 2. — 1168 с.
Лидин Р.А. и др.
Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. —
М.
: Химия, 2000. — 480 с. —
ISBN 5-7245-1163-0
.
Рипан Р., Четяну И.
Неорганическая химия. Химия металлов. —
М.
: Мир, 1972. — Т. 2. — 871 с.