Генетически модифицированный организм
- 1 year ago
- 0
- 0
Модифицированный пектин — это частично деполимеризованный и деэтерифицированный пектин с размерами, позволяющими эффективному проникновению в кровоток. По своей химической структуре модифицированный пектин относится не столько к пектинам, сколько к низкоэтерифицированным олигомерам галактуроновой кислоты.
Dr. Isaac Eliaz является одним из первых исследователей модифицированного пектина, полученного из цитрусовых , и имеющего аббревиатуру MCP. В его патентах, основанных на работах учёного , доказывается возможность использования модифицированного пектина при лечении рака простаты , лёгких . МСР препятствует росту кровеносных сосудов в опухоли, что помогает в борьбе с метастазами . Сообщается о способствовании им запрограммированной смерти раковой клетки даже в случаях андрогеннезависимых видов рака. Совет экспертов NDA (англ., Panel on Dietetic Products, Nutrition and Allergies ) Европейское агентство по безопасности продуктов питания (англ., European Food Safety Authority ) рассмотрел фармокологические свойства пектиновых производных.
Для получения модифицированного пектина могут применяться различные методы: как химический, так и ферментативный. Согласно условиям не ферментативной технологии, получается модифицированный пектин с линеарным строением, с молекулярной массой и степенью этерификации в интервалах 10-20 KDa, 5-50 %, соответственно. Ферментативный способ получения модифицированного пектина основывается на деполимеризации и деэтерифиции предварительно промышленно полученного пектина .
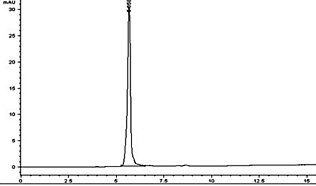
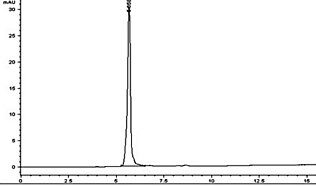
Для исследования использовались образцы модифицированного пектина, хитозана , немодифицированого пектина, полигалактуроновой кислоты. Исследования подтверждают, что модифицированный пектин ингибирует HT29 и SW480 аденокарциномы толстой кишки (англ. Cell Line human , caucasian colon adenocarcinoma grade II ) , JIMT- 1 рака молочной железы и B16 -F10 меланомы (англ. Cell Line, murine tumor melanoma ). Модифицированный пектин способен инициировать апоптоз двумя сигнальными маршрутами: внешним и внутренним. Анализ структуры модифицированных пектинов, полученных двумя рассматриваемыми способами, с помощью ВЭЖХ (англ. HPLC , High performance liquid chromatography ) показывает их идентичность. Представленный рисунок хроматограммы демонстрирует только один пик со временем удерживания 5,62-5,66 мин, характерным для пектиновых соединений. Наличие только одного пика, а также его форма подтверждают присутствие полимерных цепей одной молекулярной массы.
Производство модифицированного пектина осуществляется на объединённой промышленной линии совместно с получением пектина с низким молекулярно массовым распределением; нанопектина и наноматериалов на основе модифицированного пектина; стандартизированного пектина до 150° SAG USA желирования; диетических пищевых волокон и модифицированных пищевых волокон; соков и концентратов с повышенной замутнённостью, без осадка, с пониженной кислотностью ; низко температурно осветлённых и частично осветлённых соков и концентратов из фруктов (цитрусовых, хурмы , дыни , и т. д.). Производство обеспечено линиями рецеркулирования воды, теплоносителей, реагентов, полупродуктов, удаления пестицидов . При производстве модифицированного пектина и другой продукции из цитрусовых удаление пестицидов осуществляется способом, являющимся модификацией патента US 2007/0237844. Модифицированный способ удаляет пестициды, такие как chlorpyrifos , imazalil (синоним ) , chlorpyrifos-methyl, , , orto-fenilfenol , terbuthylazine (англ.) и другие, без отрицательного воздействия на органолептические показатели эфирных масел.
Для получения модифицированного пектина используется безотходная технология. Совместно с ним производятся пектины. Первичная структура разветвлённого ( привитого ) сополимера пектина имеет следующий вид:
В первичной структуре полимера можно выделить периодически повторяющиеся моносахаридные остатки. Это остатки галактуроновой кислоты ( DGalU ), рамнозы ( LRha ). Боковые привитые структуры состоят из арабинозы ( LAra ), галактозы ( DGal ), ксилозы (DXyl) , глюкозы (DGlu) , фруктозы (LFru) (англ., CAS registry number ). Пектин обладает сложной пространственной вторичной и надмолекулярной структурами, которые изучаются супрамолекулярной химией . Согласно своим структурным и полимерным особенностям растворение пектина происходит через стадию набухания. Причем, растворение происходит с выделением тепла.
Пектины имеют следующие характеристики: молекулярная масса 45-108 KDa; низкое молекулярно-массовое распределение; степень этерификации 12-81 %; гелеобразующая способность 200—250 o USA SAG; температура гелеобразования от 25 ° C; высокая эмульгирующая способность (20 минут при 4000-8000 rpm). Пектины бесцветны в гелях , в эмульсиях и в растворенном виде. Не содержат остатки флавоноидов и веществ, окисляющихся в результате хранения. Параметры цвета: L* в интервале 90-92; a* в интервале −3,7… −1,0; b* в интервале 2-15.
Для исследователей в области химии и медицины разработка биоматериалов для регенеративной медицины по-прежнему считается инновационной областью. Исследования показывают, что полисахариды обладают сходными свойствами с внеклеточным матриксом . Им присуще биологическая совместимость. Снижение молекулярной массы полисахаридов, например целлюлозы , способствует появлению свойств, позволяющих получать био-нанокомпозиты, нановолокна , наноматериалы. Свойствами, необходимыми для создания био-нанокомпозитов, биоматериалов тканевой инженерии , обладает и хитозан. Благодаря своей способности образовывать тонкие плёнки и волокна, уникальным сорбционным и комплексообразующим свойствам, хитозан и его производные перспективны для создания имплантатов , носителей лекарственных веществ.
Продолжаются исследования свойств, использования и получения нанопектина, с учётом данных полученных для хитозана. Условия, используемые при производстве модифицированного пектина, позволяют получать в промышленном масштабе нанопектин с молекулярными размерами 60-200 нанометров и со степенью полимеризации 30-70 мономеров.
На объединённой промышленной линии совместно производятся диетические и модифицированные пищевые волокна. Диетические пищевые волокна относятся к пребиотикам . Они используются в качестве ингредиента композита с MCP и функционально активных ингредиентов. Содержат 18-38 % водорастворимого пектина с молекулярной массой 5-48 KDa и со степенью этерификации 6-26 %; 10-23 % нерастворимого пектина с молекулярной массой 19-70 KDa и со степенью этерификации 24-39 %. Обладают водопоглощающей способностью 10-20 г/г; маслопоглощающей способностью 0,2-5,4 г/г; 100-21000 mPas*s динамической вязкостью 5 % суспензии; гелеобразующей и эмульгирующей способностями. Параметры цвета этих пищевых волокон в системе ( LAB ) CIE L*a*b*, которая была разработана международной комиссией по освещению, и, которая сейчас является международным стандартом, составляют: L* в интервале 74-87; a* в интервале (-2,6)…-(0,4); b* в интервале 14-26. Не содержат веществ, окисляемых в результате хранения.
Продукция и марка были зарегистрированы в 2017 году. Марка продукции и сама продукция относятся к классам 01 ( ингредиенты ) и 05 ( продукция фармацевтической промышленности , продукция для медицины и ветеринарии, пищевые добавки, вещества для диетического питания ) согласно международной классификации. На основе успешных промышленных экспериментов 1999 года были разработаны технологии получения продукции (2000—2012 г.г.). Продукция и технологии были запатентованы в 2002, 2004, 2013, 2014 годах. В 2018 году было зарегистрировано Know-how. Продолжаются исследования, направленные на популяризацию пектина , его низкомолекулярных производных (модифицированный пектин) с биосовместимостью и диетических пищевых волокон, содержащих пектин и модифицированный пектин. Особое внимание, по-прежнему, уделяется использованию пектина и его низкомолекулярных производных в развивающейся молекулярной ( кухни ) гастрономии и при создании биоматериалов для имплантации, тканевой инженерии. Лаборатория роста клеток и тканей института ИТЭБ PAH изучает возможность и условия использования модифицированного пектина в регенеративной медицине и 3D-биопринтинге . Задача состоит в создании органов для транслантации методом 3D-печати на биобумаге. Такая технология получения искусственных органов откроет новые возможности для медицины.