Interested Article - Правило Клечковского
- 2021-04-04
- 1

Правило Клечковского (также Правило n + l ; также используется названия правило Маделунга или принцип Ауфбау ) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах .
Правило Клечковского гласит: Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел . При одинаковой сумме раньше заполняется орбиталь с меньшим значением .
Правило n + l предложено в 1936 г. немецким физиком Э. Маделунгом ; в 1951 г. было вновь сформулировано В. М. Клечковским .
Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах
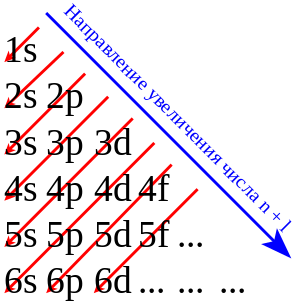
По мере увеличения заряда ядра в водородоподобных атомах атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l . Физически это означает, что в водородоподобном атоме орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра. Поэтому энергетическая последовательность орбиталей в водородоподобном атоме выглядит просто:
Здесь орбитальная энергия электрона повышается только по мере увеличения главного квантового числа n и не меняется при увеличении орбитального квантового числа l ; состояния с различными значениями l , но с одним и тем же значением n (например, 3 s , З р , 3 d ) энергетически эквивалентны, то есть соответствующие атомные орбитали (3 s , З р , 3 d ) обладают одинаковой энергией и оказываются энергетически вырожденными (не следует путать обсуждаемое вырождение по энергии атомных орбиталей различного типа в гипотетических водородоподобных атомах с энергетическим вырождением атомных орбиталей одного и того же типа, например З р x , З р у и З р z в реальных изолированных атомах).
В многоэлектронных атомах в результате межэлектронных взаимодействий происходит энергетическое расщепление (расхождение) орбиталей различного типа, но с одним и тем же значением главного квантового числа (3 s <3 p <3 d и т. д.). Если бы это расщепление было небольшим и меньшим расщепления по энергии атомных орбиталей под воздействием изменения главного квантового числа n , то энергетическая последовательность атомных орбиталей выглядела бы так:
В действительности же расщепление по l , начиная с n ≥З, оказывается большим, чем расщепление по n . Сложный характер межэлектронных взаимодействий предопределяет сильную зависимость орбитальной энергии каждого электрона уже не только от пространственной удаленности его зарядовой плотности от ядра (от главного квантового числа n ), но и от формы его движения в поле ядра (от орбитального квантового числа l ). Именно межэлектронное взаимодействие приводит к резко усложнённой (по сравнению с вышеописанной) энергетической последовательности заселяющихся электронами атомных орбиталей. Итак, в реальных многоэлектронных атомах картина энергетического распределения орбиталей оказывается очень сложной. Строгая квантовомеханическая теория электронного строения атомов и экспериментальная спектроскопия обнаруживают энергетическую последовательность атомных орбиталей в следующем виде:
Формулировка правила Клечковского
Эта энергетическая последовательность легко может быть описана при помощи эмпирического правила суммы двух первых квантовых чисел, разработанного в 1951 -м году В. М. Клечковским и иногда называемого правилом ( n + l ). Это правило основано на зависимости орбитальной энергии от квантовых чисел n и l и описывает энергетическую последовательность атомных орбиталей как функцию суммы . Суть его очень проста:
орбитальная энергия последовательно повышается по мере увеличения суммы , причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа . Например, при орбитальные энергии подчиняются последовательности , так как здесь для -орбитали главное квантовое число наименьшее , для -орбитали ; наибольшее , -орбиталь занимает промежуточное положение .
Или же:
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа и побочного (орбитального) квантового числа , то есть , имеет меньшее значение.
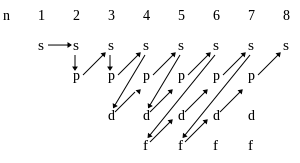
Правило ( n + l ) в целом хорошо иллюстрирует таблица 1, где по мере постепенного возрастания суммы ( n + l ) приведена энергетическая последовательность атомных орбиталей. В этой таблице не указаны нереальные (запрещенные квантовой механикой атома) варианты, для которых не выполняется обязательное требование n > l , в частности не указаны комбинации для ( n + l )=6:
| n | 1 | 2 | 3 |
| l | 5 | 4 | 3 |
| ( n + l ) | n | l | Атомные орбитали | |
|---|---|---|---|---|
| 1 | 1 | 0 | 1 s | Первый период |
| 2 | 2 | 0 | 2 s | Второй период |
| 3 | 2 | 1 | 2 p | |
| 3 | 0 | 3 s | Третий период | |
| 4 | 3 | 1 | 3 p | |
| 4 | 0 | 4 s | Четвёртый период | |
| 5 | 3 | 2 | 3 d | |
| 4 | 1 | 4 p | ||
| 5 | 0 | 5 s | Пятый период | |
| 6 | 4 | 2 | 4 d | |
| 5 | 1 | 5 p | ||
| 6 | 0 | 6 s | Шестой период | |
| 7 | 4 | 3 | 4 f | |
| 5 | 2 | 5 d | ||
| 6 | 1 | 6 p | ||
| 7 | 0 | 7 s | Седьмой период | |
| 8 | 5 | 3 | 5 f | |
| 6 | 2 | 6 d | ||
| 7 | 1 | 7 p | ||
| 8 | 0 | 8 s | Начало восьмого периода | |
Приведённую в таблице очерёдность заполнения электронами атомных орбиталей удобно представить в виде схемы:
Исключения из правила Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат атомных орбиталей только в двух однотипных случаях, а именно:
- У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s -подуровня внешнего слоя на d -подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома.
- После заполнения двумя электронами орбитали 6 s следующий электрон появляется на орбитали 5 d , а не 4 f , и только затем происходит заселение четырнадцатью электронами орбиталей 4 f , затем продолжается и завершается заселение десятиэлектронного состояния 5 d . Аналогичная ситуация характерна и для орбиталей 7 s , 6 d и 5 f .
Теоретическая и фактическая электронные конфигурации противоречащие правилу приведены в таблице.
| Атом | 24 Cr | 29 Cu | 41 Nb | 42 Mo | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 78 Pt | 79 Au | 103 Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|
|
Основная
оболочка |
[Ar] | [Ar] | [Kr] | [Kr] | [Kr] | [Kr] | [Kr] | [Kr] | [Xe] 4f 14 | [Xe] 4f 14 | [Rn] 5f 14 |
| По правилу | 3d 4 4s 2 | 3d 9 4s 2 | 4d 3 5s 2 | 4d 4 5s 2 | 4d 6 5s 2 | 4d 7 5s 2 | 4d 8 5s 2 | 4d 9 5s 2 | 5d 8 6s 2 | 5d 9 6s 2 | 6d 1 7s 2 |
| Эксперимент | 3d 5 4s 1 | 3d 10 4s 1 | 4d 4 5s 1 | 4d 5 5s 1 | 4d 7 5s 1 | 4d 8 5s 1 | 4d 10 | 4d 10 5s 1 | 5d 9 6s 1 | 5d 10 6s 1 | 7s 2 7p 1 |
Мнемоническое правило
Нас арифметикой банальною не мучай,
Над нами лишь Клечковский — господин,
А он сказал, что 3+2 получше
Чем, например, 4+1
Литература
- Корольков Д. В. Основы неорганической химии. — М.:Просвещение, 1982. — 271 с.
Примечания
- . Дата обращения: 31 октября 2010. 15 сентября 2008 года.
- 2021-04-04
- 1