Interested Article - Бромоводород
- 2021-04-22
- 1
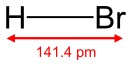
Бро́моводоро́д (гидробромид, бро́мистый водоро́д, HBr) — неорганическое вещество , бинарное соединение брома с водородом . Бесцветный тяжёлый токсичный газ , образует туман в сыром воздухе.
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений.
В лаборатории получают гидролизом трибромида или пентабромида фосфора :
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Ещë можно получить бромоводород взаимодействием воды с бромом на свету или при кипении:
Физические свойства
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле , образуя слабый электролит .
При охлаждении водных растворов HBr можно получить кристаллогидраты :
- HBr·H 2 O — устойчив при −15,5...−3,3 °C,
- HBr·2H 2 O — плавится при −11,2 °C,
- HBr·4H 2 O — плавится при −55,8 °C.
Чистый HBr образует кристаллы орторомбической сингонии , пространственная группа F mmm , параметры при −173 °C: a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
|
|
В разделе
не хватает
ссылок на источники
(см.
рекомендации по поиску
).
|
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов , синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм [ источник не указан 988 дней ] .
Токсичность

Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием [ источник не указан 988 дней ] . Предельно допустимая концентрация = 10 мг/м 3 , поражающая токсодоза = 2,4 мг/(л·мин) [ источник не указан 988 дней ] .
Примечания
- ↑
- (англ.) : A CRC quick reference handbook — CRC Press , 1993. — ISBN 978-0-8493-4498-5
- ↑
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др. — М. : Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л. : Химия, 1966. — Т. 1. — 1072 с.
- Гринвуд Н., Эрншо А. Химия элементов. — Бином. Лаборатория знаний, 2008. — Т. 2. — 666 с.
- Неорганическая химия. В 3 т. / Под ред. Ю. Д. Третьякова. — М. : Изд. центр «Академия», 2004. — Т. 2. — 368 с. — ISBN 5-7695-1436-1 .
- Ахметов Н. С. Общая и неорганическая химия: Учеб. для химико-технол. вузов. — 2-е изд., перераб. и доп. — М: Высш. шк., 1988. — 640 с., ил.
- 2021-04-22
- 1
![{\displaystyle {\ce {H2{}+Br2->[200-400~^{\circ }{\text{C, Pt}}]2HBr}}}](/images/005/577/5577568/11.jpg?rand=805825)


![{\displaystyle {\ce {3Br2{}+S{}+4H2O->[100-150~^{\circ }{\text{C}}]H2SO4{}+6HBr}}}](/images/005/577/5577568/14.jpg?rand=955110)

![{\displaystyle {\ce {KBr + H2SO4 ->[{\ce {H2O}}] KHSO4 + HBr ^}}}](/images/005/577/5577568/16.jpg?rand=449073)
![{\displaystyle {\ce {2H_2O + 2Br_2 ->[h\nu, +100^oC] 4HBr ^ + O_2 ^}}}](/images/005/577/5577568/17.jpg?rand=892722)






