Interested Article - Кислотно-основное титрование
- 2021-02-01
- 1

Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований , основанные на реакции нейтрализации:
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией . При количественном определении кислот ( алкалиметрия ) — рабочим раствором является раствор щелочи NaOH или КОН, при количественном определении щелочи (ацидиметрия) рабочим раствором является раствор сильной кислоты (обычно НСl или H 2 SO 4 ).
Конечная точка титрования
Конечная точка титрования определяется следующими способами:
- визуальным — при помощи кислотно-основных индикаторов
- потенциометрически
- кондуктометрически
- спектрофотометрически
При использовании индикаторов последние подбирают таким образом, чтобы их pH точки эквивалентности была посредине pH скачка титрования. При этом диапазон pH скачка титрования тем больше, чем сильнее титруемая кислота (основание), и тем выше точность титрования. Для слабых кислот (оснований) скачок титрования меньше, и его можно увеличить за счёт реакций комплексообразования: например, титрование слабой борной кислоты ведут в присутствии маннита.
Титрование слабых кислот (pK a >7) и слабых оснований (pK b ) ведут в неводных растворителях, в которых их кислотные (основные) свойства усиливаются. В случае слабых кислот это, например, этилендиамин и диметилформамид , в случае слабых оснований - муравьиная кислота и ледяная уксусная кислота .
Кроме определения концентрации неорганических и органических кислот и оснований, кислотно-основное титрование применяется для определения функциональных групп органических соединений ( карбоксильной , сульфо - и аминогрупп и др.).
Титрование сильной кислоты/основания сильным основанием/кислотой
pH раствора определяется концентрацией кислоты / основания , оставшихся в избытке.
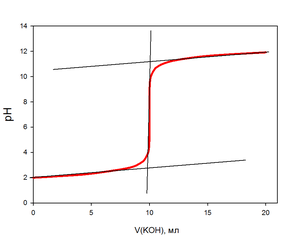
В начале титрования pH раствора изменяется незначительно, затем по мере приближения к точке эквивалентности pH начинает быстро возрастать. Скачок pH титрования является большим и зависит от концентрации реагентов: с их уменьшением величина скачка уменьшается.
При титровании сильного основания сильной кислотой кривая титрования является зеркальной.
Точка эквивалентности совпадает с точкой нейтральности.
Пример (титрование сильной кислоты сильным основанием):
- До ТЭ значение рН определяется только ионами водорода за счет неоттитрованной сильной кислоты, поскольку другими источниками ( автопротолиз воды ; углекислота , поглощенная из воздуха) можно пренебречь. рН можно рассчитать по формуле: рН = - lgc 0 - lg(1-f), где c 0 - начальная концентрация раствора сильной кислоты, f - степень оттитрованности;
- В ТЭ значение рН определяется ионами водорода, поступающими за счет автопротолиза воды (если считать, что CO 2 не поглощается): рН = ½рК w , где K w - константа автопротолиза воды;
- За ТЭ значение рН определяется избытком добавленного титранта - сильного основания по формуле: рН = рК w + lgc T + lg(f-1), где c Т - концентрация титранта .
Титрование слабой одноосновной кислоты сильным основанием/слабого основания сильной кислотой
pH раствора определяется как неполной диссоциацией слабой кислоты:
гидролизом соли в точке эквивалентности:
и буферным действием системы «слабая кислота + соль слабой кислоты». При титровании pH раствора возрастает быстрее, чем при титровании сильной кислоты, скачок pH выражен слабее, а точка эквивалентности находится при pH>7 (в щелочной зоне). Скачок pH тем слабее, чем слабее кислота, меньше её концентрация и выше температура раствора.
При титровании слабого основания сильной кислотой кривая титрования имеет зеркальный вид: pH раствора уменьшается, и точка эквивалентности находится при pH<7.
Титрование многоосновных кислот и оснований
На поведение pH на кривой титрования влияют несколько ступеней диссоциации кислоты/основания и буферное действие промежуточных солей. На кривой наблюдается несколько слабых скачков титрования.
Примечания
- .
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М. : Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5 .
- Васильев В. П. Аналитическая химия. Часть 1. Гравиметрический и титриметрический методы анализа. — М. : Высшая школа, 1989. — 320 с. — 40 000 экз. — ISBN 5-06-000066-4 .
- Основы аналитической химии / под ред. Ю. А. Золотова . — 3-е , перераб. и доп. — М. : Высш. шк., 2004. — Т. 2. — 503 с. — (Классический университетский учебник).
Ссылки
- от 16 июня 2015 на Wayback Machine
- 2021-02-01
- 1






