Interested Article - Глиоксаль
- 2021-06-15
- 1
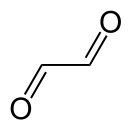
Глиокса́ль — органическое соединение , диальдегид щавелевой кислоты , жёлтая жидкость с запахом формалина . Является простейшим ди альдегидом .
Производство
В лаборатории глиоксаль получают окислением ацетальдегида селенистой кислотой .
В промышленности глиоксаль получают двумя путями. Либо окислением в газовой фазе этиленгликоля в присутствии серебряного или медного катализатора, либо окислением в жидкой фазе ацетальдегида азотной кислотой . Более распространенным является окисление в газовой фазе.
Объем ежегодного производства составляет 220 000 тонн.
Первое коммерческое производство началось в Lamotte, Франция, в 1960 и сейчас принадлежит Clariant. Единый большой производитель — BASF в Людвигсхафен-на-Рейне , Германия, с производительностью 60 000 тонн/год . Только два производства глиоксаля есть в Америке (Geismer, LA and Charlotte, NC). Значительное производство недавно началось в Китае. Коммерческий глиоксаль поставляется в виде 40 % раствора.
В России глиоксаль производит единственная компания Новохим (Novochem), с производительностью 1500 тонн/год в Томске и с сентября 2012 года в Бийске .
Получение безводного глиоксаля включает нагревание твёрдых глиоксаль гидратов с пентаоксидом фосфора и конденсация паров в охлаждаемой ловушке.
Химические свойства


Карбонильные группы глиоксаля обладают ярко выраженными электрофильными свойствами. С водой глиоксаль образует дигидрат, становясь из желтого бесцветным.
Под действием щелочи глиоксаль претерпевает внутримолекулярную реакцию Канниццаро , превращаясь в соответствующую соль гликолевой кислоты .
В присутствии поташа на воздухе окисляется до
Кислым раствором перманганата калия или перекисью водорода окисляется до муравьиной кислоты .
Щелочным раствором перманганата калия до щавелевой кислоты .
Гидрирование на палладии (Pd/C) даёт этиленгликоль .
Со спиртами в присутствии кислоты получается моно- или диацетали.
С мочевиной образует 4,5-дигидроксиимидазолидин-2-он (1) и глиоксальуреид (2).
Применение
Он используется для придания нерастворимости и как агент кросс-сочетания в химии полимеров:
- белков (процесс дубления кожи)
- коллаген
- производные целлюлозы (текстиль)
- гидроколлоиды
- крахмал (мелование бумаги)
Глиоксаль — текстильно-вспомогательное вещество, придающее несминаемость хлопчатобумажным и вискозным материалам; гидрофобизирующий компонент составов для пропитки бумаги и кожи. Глиоксаль и глиоксальсульфат используются для получения кубовых красителей .
Глиоксаль ценный строительный блок в органическом синтезе, особенно в синтезе гетероциклов таких как имидазол . Обычная форма этого реагента используемого в лабораториях — бис -полуацеталь с этиленгликолем 1,4-диоксан-2,3-диол. Он доступен коммерчески.
Поведение в растворе

Глиоксаль типично поставляется в виде 40 % водного раствора. Как и другие низшие альдегиды, глиоксаль образует гидраты. Более того, гидраты конденсируются, образуя серии олигомеров, структуры которых остаются неизвестными. Для большинства применений точное знание структуры этих олигомеров не имеет значения.
По крайней мере два типа гидратов доступны коммерчески и являются твёрдыми веществами:
- глиоксаль димер, дигидрат: , 1,4-диоксан-транс-2,3-диол (CAS# 4845-50-5, температура плавления 91—95 °C) ;
- глиоксаль тример, дигидрат: (CAS# 4405-13-4), не гигроскопичен.
Установлено, что при концентрации меньшей 1 М глиоксаль существует в основном как мономер или его гидраты, , или .
При концентрации большей 1 М димер доминирует. Эти димеры скорее всего представляют собой диоксоланы с формулой . Димер и тример могут выпасть в осадок из-за низкой растворимости при температуре ниже 15 °C.
Безопасность
Вещество относительно малотоксично, ЛД50 для крыс, перорально, составляет 3300 мг/кг , для сравнения, токсичность поваренной соли — 3000 мг/кг .
Беречь от прямых солнечных лучей. Раздражает кожу. Работы с веществом проводить в вытяжном шкафу.
Примечания
- (англ.) : A CRC quick reference handbook — CRC Press , 1993. — ISBN 978-0-8493-4498-5
- . Дата обращения: 25 июня 2009. Архивировано из 23 мая 2009 года.
- . Дата обращения: 7 октября 2012. 14 октября 2012 года.
- Химическая энциклопедия, т. 1, 1988, «Сов. энциклопедия», стр. 583
- Mattioda, Georges; Blanc, Alain. "Glyoxal". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a12_491.pub2
- . ox.ac.uk . Архивировано из 7 июня 2011 года.
Ссылки
- Колотов С. С. , Менделеев Д. И. // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб. , 1890—1907.
- 2021-06-15
- 1
![{\displaystyle {\ce {[(CHO)2]2(H2O)2}}}](/images/005/592/5592679/8.jpg?rand=917996)
![{\displaystyle {\ce {[(CHO)2]3(H2O)2}}}](/images/005/592/5592679/9.jpg?rand=490528)



![{\displaystyle {\ce {[(HO)CH]2O2CHCHO}}}](/images/005/592/5592679/13.jpg?rand=774979)

