Interested Article - Ингибирование ферментов

- 2020-09-04
- 1
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы (см. ниже).
Изучение ингибирования ферментов играет важную роль в создании лекарств , в изучении механизма действия и структуры ферментов.
Обратимое ингибирование
Конкурентное ингибирование
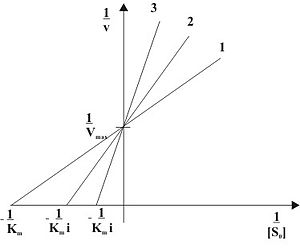
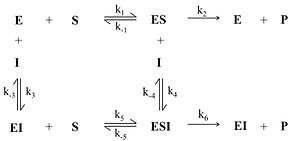
В этом случае ингибитор связывается в активном центре фермента и конкурирует за него с субстратом . Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом (ES на рис.1), то есть константа диссоциации K i ' >> 1.
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Схема конкурентного ингибирования и
уравнение Михаэлиса-Ментен
для него выглядят следующим образом:
|
|
|
Видно, что при конкурентном ингибировании максимальная скорость реакции V max не меняется, а кажущаяся константа Михаэлиса увеличивается в (1 + [ I ]/ K i ) раз. Поэтому в двойных обратных Лайнвивера-Берка (зависимость 1/ v 0 от 1/[ S ]) при разных концентрациях ингибитора получают семейство прямых с различным наклоном, пересекающихся в одной точке на оси ординат.
Константу ингибирования K i обычно определяют так: проводят ряд измерений кажущейся константы Михаэлиса при различных концентрациях ингибитора, затем строят зависимость этой величины от концентрации ингибитора. Тангенс угла наклона полученной прямой равен K m / K i .
Неконкурентное ингибирование
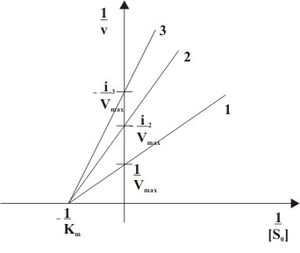
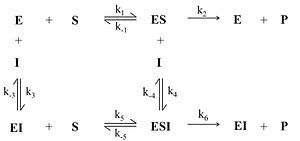
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
|
|
|
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [ I ]/ K i ) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.
Бесконкурентное ингибирование
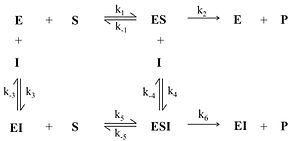
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:
|
|
|
Максимальная скорость реакции и кажущаяся константа Михаэлиса уменьшаются в одинаковое число раз. Поэтому в двойных обратных координатах для разных концентраций ингибитора получаем семейство параллельных прямых.
Ингибирование субстратом
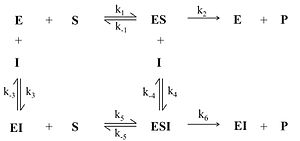
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Схема и уравнение Михаэлиса-Ментен в случае ингибирования субстратом:
|
|
|
Необратимое ингибирование
Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения удельной активности фермента, как в случае
Аллостерическое ингибирование
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
Ссылки
- 2020-09-04
- 1



![v_{0}={\frac {V_{{max}}[S]}{[S]+K_{m}(1+{\frac {[I]}{K_{i}}})}}](/images/005/595/5595637/7.jpg?rand=675444)



![v_{0}={\frac {{\frac {V_{{max}}}{(1+{\frac {[I]}{K_{i}}})}}[S]}{[S]+K_{m}}}](/images/005/595/5595637/12.jpg?rand=404061)



![v_{0}={\frac {{\frac {V_{{max}}}{(1+{\frac {[I]}{K_{I}}})}}[S]}{[S]+{\frac {K_{m}}{(1+{\frac {[I]}{K_{I}}})}}}}](/images/005/595/5595637/17.jpg?rand=184183)



![v_{0}={\frac {V_{{max}}[S]}{[S]+K_{m}+{\frac {[S]^{2}}{K_{I}}}}}](/images/005/595/5595637/21.jpg?rand=884757)