Interested Article - Гипохлорит натрия

- 2021-12-15
- 1
Гипохлори́т на́трия ( на́трий хлорноватистоки́слый , химическая формула — NaOCl ) — неорганическая натриевая соль хлорноватистой кислоты . Тривиальное (историческое) название водного раствора соли — « лабарракова вода » или « жавелевая вода » .
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H 2 O или водного раствора, имеющего характерный резкий запах.
Сильный окислитель , содержит 95,2 % активного хлора . Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Применяется в медицине в качестве бактерицидного и стерилизующего средства , а также в пищевой промышленности и сельском хозяйстве .
По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007) , гипохлорит натрия входит в сотню самых важных химических соединений.
История открытия
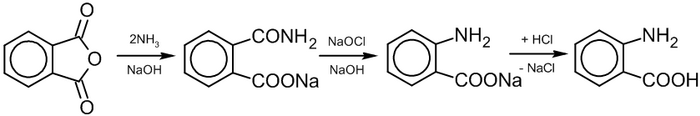
В 1774 году шведским химиком Карлом Вильгельмом Шееле был открыт хлор . Спустя 11 лет в 1785 году (по другим данным — в 1787 году ), другой химик, француз Клод Луи Бертолле , обнаружил, что водный раствор этого газа (см. уравнение (1) ) обладает отбеливающими свойствами .
Небольшое Парижское предприятие Societé Javel , открытое в 1778 году на берегах Сены и возглавляемое Леонардом Альбаном ( англ. Leonard Alban ), адаптировало открытие Бертолле к промышленным условиям и начало выпуск белильной жидкости, растворяя газообразный хлор в воде. Однако получаемый продукт был очень нестабильным, поэтому в 1787 году процесс был модифицирован. Хлор стали пропускать через водный раствор поташа (карбоната калия) (см. уравнение (2) ), в результате чего образовывался стабильный продукт, обладающий высокими отбеливающими свойствами. Альбан назвал его «Eau de Javel» (« жавелевая вода »). Новый продукт стал моментально популярен во Франции и Англии из-за лёгкости его перевозки и хранения .
В 1820 году французский фармацевт Антуан Лабаррак ( фр. Antoine Germain Labarraque ) заменил поташ на более дешёвую каустическую соду (гидроксид натрия) (см. уравнение (3) ). Получившийся раствор гипохлорита натрия получил название « Лабарракова вода » ( фр. Eau de Labarraque ). Он стал широко использоваться для отбеливания и дезинфекции . Реакция протекает в холодном разбавленном растворе:
Несмотря на то, что дезинфицирующие свойства гипохлорита были обнаружены в первой половине XIX века, использование его для обеззараживания питьевой воды и очистки сточных вод началось только в конце века. Первые системы водоочистки были открыты в 1893 году в Гамбурге ; в США первый завод по производству очищенной питьевой воды появился в 1908 году в Джерси-Сити .
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C) .
У соединения известно три кристаллогидрата :
- моногидрат NaOCl · H 2 O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом .
- NaOCl · 2,5H 2 O — более устойчив, плавится при 57,5 °C .
- пентагидрат NaOCl · 5H 2 O — наиболее устойчивая форма, представляет собой бледно-зеленовато-жёлтые (технического качества — белые ) ромбические кристаллы ( a = 0,808 нм , b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен , хорошо растворим в воде (в г/100 граммов воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения . Температура плавления : 24,4 °C (по другим данным: 18 °C ), при нагревании (30—50 °C) разлагается .
Плотность водного раствора гипохлорита натрия при 18 °C :
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Плотность , г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций :[стр. 458] :
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания , °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе :
- стандартная энтальпия образования , ΔH o 298 : −350,4 кДж/моль;
- стандартная энергия Гиббса , ΔG o 298 : −298,7 кДж/моль.
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода :
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H 2 O) теряет 30 % активного хлора . При температуре 70 °C разложение безводного гипохлорита протекает со взрывом .
При нагревании параллельно происходит реакция диспропорционирования (дисмутации) :
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы :
Так как хлорноватистая кислота (HOCl) очень слабая ( pK a = 7,537 ), гипохлорит-ион в водной среде подвергается гидролизу :
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства (см. раздел « »).
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки ). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов ; напротив, сульфат магния , ортоборная кислота , силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой ( pH > 11) .
В сильнощелочной среде ( pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом :
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования (дисмутации) :
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме :
В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH < 3) при комнатной температуре наблюдается распад по следующей схеме :
Если для подкисления используется соляная кислота , в результате выделяется хлор :
Пропуская через насыщенный водный раствор гипохлорита натрия углекислый газ , можно получить раствор хлорноватистой кислоты:
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель , вступающий в многочисленные реакции с разнообразными восстановителями , независимо от кислотно-щелочного характера среды .
Основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде :
-
- в кислой среде:
-
- в нейтральной и щелочной среде:
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
-
- Фосфор и мышьяк растворяются в щелочном растворе гипохлорита натрия, образуя соли фосфорной и мышьяковой кислот :[стр. 169] :
- См. подробнее подраздел « ».
-
- Соединения металлов с низшими степенями окисления превращаются в соединения с высшими степенями окисления :[стр. 138, 308] :[стр. 200] :
- По аналогии можно осуществить превращения: Fe(II) → Fe(III) → Fe(VI) ; Co(II) → Co(III) → Co(IV) ; Ni(II) → Ni(III) ; Ru(IV) → Ru(VIII) ; Ce(III) → Ce(IV) и прочие .
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита):
Другой вариант — иодкрахмальная реакция в сильнокислой среде и цветная реакция с 4,4’-тетраметилдиаминодифенилметаном или n, n ’-диокситрифенилметаном в присутствии бромата калия .
Распространённым методом количественного анализа гипохлорита натрия в растворе является потенциометрический анализ методом добавок анализируемого раствора к стандартному раствору (МДА) или метод уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору (МУА) с использованием бром-ионоселективного электрода (Br-ИСЭ) .
Также используется титриметрический метод с использованием иодида калия (косвенная иодометрия ) .
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные :
| Материал | Концентрация NaOCl, масс. % | Форма воздействия | Температура, °C | Скорость и характер коррозии |
|---|---|---|---|---|
| Алюминий | — | твёрдый, влажный | 25 | > 10 мм/год |
| 10; pH>7 | водный раствор | 25 | > 10 мм/год | |
| Медь | 2 | водный раствор | 20 | < 0,08 мм/год |
| 20 | водный раствор | 20 | > 10 мм/год | |
|
Медные сплавы:
БрА5, БрА7, Л59, Л63, Л68, Л80, ЛО68-1 |
10 | водный раствор | 20 | > 10 мм/год |
| Никель | < 34 | водный раствор | 20 | 0,1—3,0 мм/год |
| Никелевый сплав НМЖМц28-2,5-1,5 | < 34; активный хлор: 3 | водный раствор | 20 | 0,007 мм/год |
| Никелевый сплав Н70МФ | < 34 | водный раствор | 35—100 | < 0,004 мм/год |
| Платина | < 34 | водный раствор | < 100 | < 0,1 мм/год |
| Свинец | < 34; активный хлор: 1 | водный раствор | 20 | 0,54 мм/год |
| 40 | 1,4 мм/год | |||
| Серебро | < 34 | водный раствор | 20 | < 0,1 мм/год |
| Сталь Ст3 | — | твёрдый, безводный | 25—30 | < 0,05 мм/год |
| 0,1; pH > 10 | водный раствор | 20 | < 0,1 мм/год | |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Сталь 12Х17, 12Х18Н10Т | 5 | водный раствор | 20 | > 10,0 мм/год |
| Сталь 10Х17Н13М2Т | < 34; активный хлор: 2 | водный раствор | 40 | < 0,001 мм/год |
| T кип. | 1,0—3,0 мм/год | |||
| Сталь 06ХН28МДТ | < 34 | водный раствор | 20—T кип. | < 0,1 мм/год |
| Тантал | < 34 | водный раствор | 20 | < 0,05 мм/год |
| Титан | 10—20 | водный раствор | 25—105 | < 0,05 мм/год |
| 40 | водный раствор | 25 | < 0,05 мм/год | |
| Цирконий | 10 | водный раствор | 30—110 | < 0,05 мм/год |
| 20 | водный раствор | 30 | < 0,05 мм/год | |
| Чугун серый | < 0,1; pH > 7 | водный раствор | 25 | < 0,05 мм/год |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Чугун СЧ15, СЧ17 | < 34 | водный раствор | 25—105 | < 1,3 мм/год |
| Асбест | 14 | водный раствор | 20—100 | стоек |
| Графит , пропитанный феноло-формальдегидным олигомером | 25 | водный раствор | Т кип. | стоек |
| Полиамиды | < 34 | водный раствор | 20—60 | стоек |
| Поливинилхлорид | < 34 | водный раствор | 20 | стоек |
| 65 | относительно стоек | |||
| Полиизобутилен | < 34 | водный раствор | 20 | стоек |
| 60 | относительно стоек | |||
| 100 | нестоек | |||
| Полиметилметакрилат | < 34 | водный раствор | 20 | стоек |
| Полиэтилен | < 34 | водный раствор | 20—60 | стоек |
| Полипропилен | < 34 | водный раствор | 20—60 | стоек |
| Резина на основе бутилкаучука | 10 | водный раствор | 20—65 | стоек |
| насыщенный | водный раствор | 65 | стоек | |
| Резина на основе натурального каучука | 10—30 | водный раствор | 65 | стоек |
| Резина на основе кремнийорганического каучука | любая | водный раствор | 20—100 | стоек |
| Резина на основе фторкаучука | < 34 | водный раствор | 20—93 | стоек |
| Резина на основе хлоропренового каучука | 20 | водный раствор | 24 | относительно стоек |
| насыщенный | водный раствор | 65 | нестоек | |
| Резина на основе хлорсульфированного полиэтилена | < 34 | водный раствор | 20—60 | стоек |
| Стекло | < 34 | водный раствор | 20—60 | стоек |
| Фторопласт | любая | водный раствор | 20—100 | стоек |
| Эмаль кислотостойкая | любая | водный раствор | < 100 | стоек |
| Т кип. | относительно стоек |
Физиологическое действие и воздействие на окружающую среду
NaOCl одно из лучших известных средств, проявляющих благодаря гипохлорит-иону сильную антибактериальную активность. Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях. В водном растворе имеет характерный горько-солоновато-кислый вяжущий вкус.
Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO − приблизительно равны (см. подраздел « »). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода , обладающего высоким биоцидным действием . Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя со способными к окислению биополимерами в их структуре. Исследованиями установлено, этот процесс аналогичен тому, что происходит естественным образом во всех высших организмах. Некоторые клетки человека ( нейтрофилы , гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями .
Дрожжеподобные грибы, вызывающие кандидоз , Candida albicans , погибают in vitro в течение 30 секунд при действии 5,0—0,5%-го раствора NaOCl; при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость спустя 24 часа после воздействия. Более резистентны к действию гипохлорита натрия энтерококки . Так, например, патогенный погибает через 30 секунд после обработки 5,25%-м раствором и через 30 минут после обработки 0,5%-м раствором. Грамотрицательные анаэробные бактерии, такие как , и , погибают в течение 15 секунд после обработки 5,0—0,5%-м раствором NaOCl .
Несмотря на высокую биоцидную активность гипохлорита натрия, следует иметь в виду, что некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза , устойчивы к его действию.
Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов . В приведённой ниже таблице представлены результаты инактивации токсинов при 30-минутной экспозиции различных концентраций NaOCl ( «+» — токсин инактивирован; «−» — токсин остался активен) :
| Токсин |
2,5 % NaOCl +
0,25 н NaOH |
2,5 % NaOCl | 1,0 % NaOCl | 0,1 % NaOCl |
|---|---|---|---|---|
| Т-2 токсин | + | − | − | − |
| Бреветоксин | + | + | − | − |
| Микроцистин | + | + | + | − |
| Тетродотоксин | + | + | + | − |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
В больших концентрациях на организм человека гипохлорит натрия может оказывать вредное воздействие. Растворы NaOCl могут быть опасны при ингаляционном воздействии из-за возможности выделения токсичного хлора (раздражающий и удушающий эффект). Прямое попадание гипохлорита в глаза, особенно при высоких концентрациях, может вызвать химический ожог и даже привести к частичной или полной потере зрения . Бытовые отбеливатели на основе NaOCl могут вызвать раздражение кожи, а промышленные привести к серьёзным язвам и отмиранию ткани. Приём внутрь разбавленных растворов (3—6 %) гипохлорита натрия приводит обычно только к раздражению пищевода и иногда ацидозу , в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации желудочно-кишечного тракта .
Несмотря на свою высокую химическую активность, безопасность гипохлорита натрия для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы, которые показывают, что вещество в рабочих концентрациях не несёт каких-либо серьёзных последствий для здоровья после непреднамеренного проглатывания или попадания на кожу. Также подтверждено, что гипохлорит натрия не является мутагенным , канцерогенным и тератогенным соединением, а также кожным аллергеном . Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку NaOCl, не содержит человеческих канцерогенов .
Пероральная токсичность соединения :
- Мыши: ЛД 50 ( англ. LD 50 ) = 5800 мг/кг;
- Человек (женщины): минимально известная токсическая доза ( англ. TD Lo ) = 1000 мг/кг.
Внутривенная токсичность соединения :
- Человек: минимально известная токсическая доза ( англ. TD Lo ) = 45 мг/кг.
При обычном бытовом использовании гипохлорит натрия распадается в окружающей среде на поваренную соль , воду и кислород . Другие вещества могут образоваться в незначительном количестве. По заключению Шведского института экологических исследований, гипохлорит натрия, скорее всего, не создаёт экологических проблем при его использовании в рекомендованном порядке и количествах .
Гипохлорит натрия не представляет угрозы с точки зрения пожароопасности.
Рейтинг
NFPA 704
для концентрированных растворов (10—20 %)
:
![]()
![]()
![]()
Лабораторные методы получения
Основным лабораторным методом получения гипохлорита натрия является пропускание газообразного хлора через охлаждённый насыщенный раствор гидроксида натрия :
Для отделения из реакционной смеси хлорида натрия (NaCl) используют охлаждение до температуры близкой к 0 °C — в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (−40 °C) и последующей кристаллизацией при −5 °C получают пентагидрат гипохлорита натрия NaOCl · 5H 2 O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой .
Вместо гидроксида для синтеза можно взять карбонат натрия :
Водный раствор гипохлорита натрия можно получить обменной реакцией карбоната натрия с гипохлоритом кальция :
Промышленное производство
Мировое производство
Потребление гипохлорита натрия в мире постоянно растёт, но оценка мирового объёма производства представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу «in situ» , то есть на месте его непосредственного потребления. Это обусловлено недостаточной для длительного хранения стабильностью растворов гипохлорита натрия, особенно при повышенной температуре (см. ниже). Мировой рынок гипохлорита натрия составил в 2020 году 261,7 млн. долларов США и, по прогнозам, достигнет размера в 385,6 млн. долларов США к 2028 году при среднем росте 5% в год.
По данным на 2017 год , объём гипохлорита натрия для промышленного применения в США и России составляет 1700 тыс. т в год и 87 тыс. т в год соответственно. Бытовое применение в двух странах: 2500 тыс. т/г приходится на США и лишь 32 тыс. т/г потребляет Россия .
Обзор промышленных способов получения
Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.
В современной промышленности существует два основных метода производства гипохлорита натрия:
- химический метод — хлорирование водных растворов гидроксида натрия ;
- электрохимический метод — электролиз водного раствора хлорида натрия .
В свою очередь, способ химического хлорирования, предлагает две производственные схемы:
- основной процесс , где в качестве конечного продукта образуется разбавленный (около 16 % NaOCl) раствор гипохлорита с примесью хлорида и гидроксида натрия;
- низко-солевой или концентрированный процесс — позволяет получить концентрированный (25—40 % NaOCl) с меньшим уровнем загрязнения :[стр. 447—449] .
Химический метод
Сущность химического метода получения NaOCl не изменилась с момента его открытия Лабарраком (см. подраздел « »), и заключается во взаимодействии газообразного хлора с едким натром :
Современный химический гигант Dow Chemical Company был одной из первых компаний, поставивших производство гипохлорита натрия на масштабную промышленную основу. В 1898 году открылся первый завод компании по выпуску NaOCl химическим способом. Другой компанией, благодаря которой, это вещество достигло сегодняшней популярности, стала Clorox — крупнейший производитель бытовых отбеливателей в США . С момента основания в 1913 году , вплоть до 1957 года , когда компанию приобрёл концерн Procter & Gamble , отбеливатель на основе гипохлорита натрия Clorox Bleach® был единственным продуктом в её ассортименте .
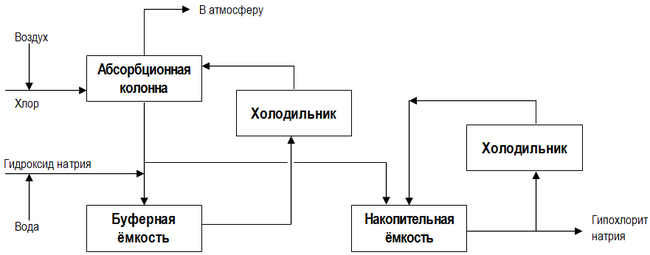
Современная технологическая схема непрерывного производства гипохлорита натрия представлена на рисунке :[стр. 442] :
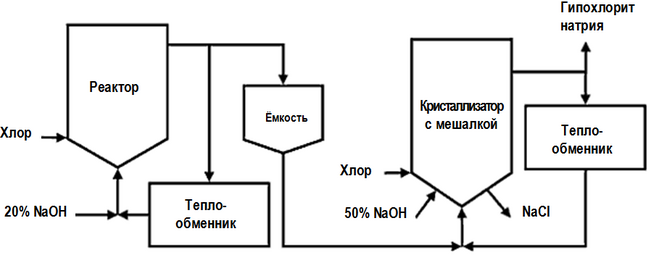
Низкосолевой процесс производства, в отличие от основной технологической схемы, представленной выше, включает в себя две стадии хлорирования, причём в кристаллизатор (см. на рисунке), где происходит концентрирование готового продукта, подаётся разбавленный раствор NaOCl из первого реактора :[стр. 450] :
В России товарный гипохлорит натрия производят следующие предприятия [ значимость факта? ] :
- «Каустик», ЗАО ( Стерлитамак ) ;
- «Каустик», ОАО ( Волгоград ) ;
- «Новомосковский хлор», ООО ( Новомосковск ) .
- «Саянскхимпласт» (Саянск);
Электрохимический метод
Электрохимический метод получения гипохлорита натрия заключается в электролизе водного раствора хлорида натрия или морской воды в электролизёре с полностью открытыми электродными зонами (бездиафрагменный способ), то есть продукты электролиза свободно смешиваются в электрохимическом процессе .
Процесс на аноде :
Процесс на катоде :
Процесс в электролизёре за счёт химического взаимодействия образующихся продуктов:
Общая схема процесса:
Электрохимический метод используется, в основном, для получения дезинфицирующего раствора для систем водоочистки. Удобство этого метода заключается в том, что производство гипохлорита не требует поставок хлора, его можно производить сразу на месте водоподготовки, избежав, тем самым, расходов на доставку; кроме того, метод позволяет производить гипохлорит в достаточно широком диапазоне объёмов выработки: от очень малых до крупнотоннажных .
В мире существуют множество различных производителей электролизёров для получения растворов гипохлорита натрия, среди которых наиболее распространены системы компании Severn Trent De Nora : Seaclor и Sanilec .
Система Seaclor ® является преобладающей технологией производства гипохлорита натрия из морской воды электрохимическим методом, занимая свыше 70 % всех мировых мощностей. Более 400 установок Seaclor ® работают в 60 странах; их суммарная производительность составляет порядка 450 тыс. тонн NaOCl в год, единичная мощность колеблется в диапазоне 227—22 680 кг/день . Установки позволяют получать концентрацию активного хлора в растворе в диапазоне 0,1—0,25 % .
Установки Sanilec ® выпускаются производительностью от 1,2 (портативные генераторы) до 21 600 кг/день , концентрация активного хлора составляет 0,05—0,25 % .
Характеристика продукции, обращение, хранение и транспортировка
В Российской Федерации гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76 «Гипохлорит натрия. Технические условия». В соответствии с этим документом, по назначению NaOCl делится на две марки, характеристики которых представлены ниже :
| Наименование показателя | Марка А | Марка Б |
|---|---|---|
| Внешний вид | Жидкость зеленовато-жёлтого цвета | |
| Коэффициент светопропускания | Не менее 20 % | |
| Массовая концентрация активного хлора, г/дм³, не менее | 190 | 170 |
| Массовая концентрация щёлочи в пересчёте на NaOH, г/дм³ | 10—20 | 40—60 |
| Массовая концентрация железа, г/дм³, не более | 0,02 | 0,06 |
| Область применения | В химической промышленности для обеззараживания воды, дезинфекции и отбелки | В витаминной промышленности (как окислитель) и для отбеливания ткани |
Гипохлорит натрия должен храниться в защищённых от света, специальных полиэтиленовых, стальных гуммированных или других, покрытых коррозионно-стойкими материалами ёмкостях, наполненных на 90 % объёма и оборудованных воздушником для сброса образующегося при распаде кислорода . Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов .
Растворы товарного гипохлорита натрия со временем теряют свою активность из-за разложения NaOCl. Следующая таблица наглядно показывает, что с течением времени концентрация активного вещества в растворах уменьшается. Тем не менее, как видно из полученной диаграммы, с уменьшением концентрации гипохлорита скорость его распада также уменьшается и промышленные растворы стабилизируются :[стр. 469] :

| Концентрация NaOCl, % | Период полуразложения, дней | |
|---|---|---|
| 25 °C | 35 °C | |
| 15 | 144 | 39 |
| 12 | 180 | 48 |
| 9 | 240 | 65 |
| 6 | 360 | 97 |
| 3 | 720 | 194 |
| 1 | 2160 | 580 |
Наиболее стабильны для хранения водные растворы гипохлорита, имеющие pH в диапазоне 11,86−13 :[стр. 470] .
Применение
Обзор направлений использования

Гипохлорит натрия является безусловным лидером среди гипохлоритов других металлов, имеющих промышленную значимость, занимая 91 % мирового рынка. Почти 9 % остаётся за гипохлоритом кальция , гипохлориты калия и лития имеют незначительные объёмы использования .
Весь широкий спектр использования гипохлорита натрия можно разбить на три условные группы:
- использование для бытовых целей ;
- использование для промышленных целей ;
- использование в медицине .
Бытовое использование включает в себя:
- использование в качестве средства для дезинфекции и антибактериальной обработки;
- использование для отбеливания тканей;
- химическое растворение санитарно-технических отложений.
Промышленное использование включает в себя:
- промышленное отбеливание ткани, древесной массы и некоторых других продуктов;
- промышленная дезинфекция и санитарно-гигиеническая обработка;
- очистка и дезинфекция питьевой воды для систем коммунального водоснабжения;
- очистка и обеззараживание промышленных стоков;
- химическое производство.
По оценке экспертов от 17 декабря 2014 на Wayback Machine , около 67 % всего гипохлорита натрия используется в качестве отбеливателя и 33 % для нужд дезинфекции и очистки, причём последнее направление имеет тенденцию к росту. Наиболее распространённое направление промышленного использования гипохлорита (60 %) — дезинфекция промышленных и бытовых сточных вод. Общий глобальный рост объёмов промышленного потребления NaOCl в 2012—2017 гг оценивается в 2,5 % ежегодно. Рост мирового спроса на гипохлорит натрия для бытового использования в 2012—2017 гг оценивается примерно в 2 % ежегодно .

Применение в бытовой химии
Гипохлорит натрия находит широкое применение в бытовой химии и входит в качестве активного ингредиента в состав многочисленных средств, предназначенных для отбеливания, очистки и дезинфекции различных поверхностей и материалов. В США примерно 80 % всего гипохлорита, используемого домохозяйствами, приходится на бытовое отбеливание . Обычно в быту применяются растворы с концентрацией в диапазоне от 3 до 6 % гипохлорита .
Коммерческая доступность и высокая эффективность действующего вещества определяет его широкое использование различными производственными компаниями, где гипохлорит натрия или средства на его основе выпускаются под различными торговыми марками, некоторые из которых представлены в таблице:
| Торговая марка | Производитель | Назначение | Концентрация NaOCl |
|---|---|---|---|
| Белизна | ОАО «Саянскхимпласт» | Бытовой отбеливатель, пятновыводитель и дезинфицирующее средство | 70—85 г/дм 3 активного хлора |
| Clorox Regular-Bleach | The Clorox Company | Бытовой отбеливатель, пятновыводитель и дезинфицирующее средство | 6 % |
| Clorox Washing Machine Cleaner | The Clorox Company | Очиститель для стиральных машин | 5—10 % |
| Cascade Complete® with Bleach (gel) | Procter & Gamble Company | Средство для автоматических посудомоечных машин | 1—5 % |
| Aquachem Chlorinizor | Средство для дезинфекции бассейнов | 10 % | |
| Brite Bleach | Sunbelt Chemicals Corp. | Бытовой отбеливатель и дезинфицирующее средство | 5,25 % |
| Lysol Bleach Toilet Bowl Cleaner | Reckitt Benckiser | Средство для очистки туалета | 2 % |
| Tiret | Reckitt Benckiser | Средство для устранения засоров труб | нет данных |
| Domestos гель | Unilever | Средство для чистки и дезинфекции | 5 % |
Применение в медицине
Использование гипохлорита натрия для дезинфекции ран впервые было предложено не позднее 1915 года . В современной медицинской практике антисептические растворы гипохлорита натрия используются в основном для наружного и местного применения в качестве противовирусного , противогрибкового и бактерицидного средства при обработке кожи, слизистых оболочек и ран . Гипохлорит активен в отношении многих грамположительных и грамотрицательных бактерий , большинства патогенных грибов , вирусов и простейших , хотя его эффективность снижается в присутствии крови или её компонентов .
Низкая стоимость и доступность гипохлорита натрия делает его важным компонентом для поддержания высоких гигиенических стандартов во всём мире. Это особенно ярко проявляется в развивающихся странах , где использование NaOCl стало решающим фактором для остановки холеры , дизентерии , брюшного тифа и других водных биотических заболеваний. Так, при вспышке холеры в странах Латинской Америки и Карибского бассейна в конце XX века благодаря гипохлориту натрия удалось свести к минимуму заболеваемость и смертность, что было сообщено на симпозиуме по тропическим болезням, проводимого под эгидой Института Пастера .
Для медицинских целей в России гипохлорит натрия используется в качестве 0,06%-го раствора для внутриполостного и наружного применения, а также раствора для инъекций. В хирургической практике он применяется для обработки, промывания или дренирования операционных ран и интраоперационной санации плевральной полости при гнойных поражениях; в акушерстве и гинекологии — для периоперационной обработки влагалища, лечения бартолинита , кольпита , трихомониаза , хламидиоза , эндометрита , аднексита и т. п.; в оториноларингологии — для полосканий носа и горла, закапывания в ; в дерматологии — для влажных повязок, примочек, компрессов при различных видах инфекций .
В стоматологической практике гипохлорит натрия наиболее широко применяется в качестве антисептического ирригационного раствора (концентрация NaOCl 0,5—5,25 %) в эндодонтии . Популярность NaOCl определяется общедоступностью и дешевизной раствора, а также бактерицидным и противовирусным эффектом в отношении таких опасных вирусов как ВИЧ , ротавирус , вирус герпеса , вирусы гепатита A и B . Имеются данные об использовании гипохлорита натрия для лечения вирусных гепатитов : он обладает широким спектром противовирусных, детоксикационных и антиоксидантных эффектов . Растворы NaOCl можно использовать в целях стерилизации некоторых медицинских изделий, предметов ухода за больными, посуды, белья, игрушек, помещений, твёрдой мебели, сантехнического оборудования. Из-за высокой коррозионной активности гипохлорит не применяют для металлических приборов и инструментов. Отметим также применение растворов гипохлорита натрия в ветеринарии : они используются для дезинфекции животноводческих помещений .
Промышленное применение
Применение в качестве промышленного отбеливателя
Использования гипохлорита натрия в качестве отбеливателя является одним из приоритетных направлений промышленного использования наряду с дезинфекцией и очисткой питьевой воды. Мировой рынок только в этом сегменте превышает 4 млн тонн .
Обычно для промышленных нужд в качестве отбеливателя используются водные растворы NaOCl, содержащие 10—12 % действующего вещества .
Гипохлорит натрия широко используется в качестве отбеливателя и пятновыводителя в текстильном производстве и промышленных прачечных и химчистках. Он может быть безопасно использован для многих видов тканей, включая хлопок , полиэстер , нейлон , ацетат , лён , вискозу и другие. Он очень эффективен для удаления следов почвы и широкого спектра пятен, в том числе крови, кофе, травы, горчицы, красного вина и т. д.
Гипохлорит натрия также используется в целлюлозно-бумажной промышленности для отбелки древесной массы . Отбелка с использованием NaOCl обычно следует за этапом и является одной из ступеней химической переработки древесины, используемой для достижения высокой степени белизны целлюлозы . Обработку волокнистых полуфабрикатов проводят в специальных башнях гипохлоритной отбелки в щелочной среде (pH 8—9), температуре 35—40 °C, в течение 2—3 часов. В течение этого процесса происходит окисление и хлорирование лигнина , а также разрушение хромофорных групп органических молекул .
Применение в качестве промышленного дезинфицирующего средства
Широкое применение гипохлорита натрия в качестве промышленного дезинфицирующего средства связано, прежде всего, со следующими направлениями :
- дезинфекция питьевой воды перед подачей в распределительные системы городского водоснабжения;
- дезинфекция и альгицидная обработка воды плавательных бассейнов и прудов;
- обработка бытовых и промышленных сточных вод, очистка от органических и неорганических примесей;
- в пивоварении, виноделии, молочной промышленности — дезинфекция систем, трубопроводов, резервуаров;
- фунгицидная и бактерицидная обработка зерна;
- дезинфекция воды рыбохозяйственных водоёмов;
- дезинфекция технических помещений.
Гипохлорит как дезинфектант входит в состав некоторых средств для поточной автоматизированной мойки посуды и некоторых других жидких синтетических моющих средств .
Промышленные дезинфицирующие и отбеливающие растворы выпускаются многими производителями под различными торговыми марками, некоторые из которых представлены в таблице:
| Торговая марка | Производитель | Назначение | Концентрация NaOCl |
|---|---|---|---|
|
Гиподез |
ООО «ДонДез» | средство для дезинфекции и санитарной обработки | 4 % (в пересчёте на активный хлор) |
|
Форэкс-Хлор |
ДНПК «Альфа» | средство для дезинфекции и санитарной обработки | 4 % (в пересчёте на активный хлор) |
|
СТЭК |
Kemira oyj | средство для водоподготовки, дезинфекции, обработки воды в бассейнах | не менее 180 г/л (в пересчёте на активный хлор) |
|
Аква-Кемикал |
Kemira oyj, ООО «Скоропусковский синтез» | средство для водоподготовки и дезинфекции | не менее 180 г/л (в пересчёте на активный хлор) |
|
Рекон |
Kemira oyj | средство для обработки воды в бассейнах, проведения водоподготовки и дезинфекции | не менее 180 г/л (в пересчёте на активный хлор) |
|
Эмовекс |
ООО «Макропул Кемиклс» | средство для дезинфекции бассейнов | не менее 130 г/л (в пересчёте на активный хлор) |
|
Bleach Concentratte |
Harvard Chemical Company | промышленный отбеливатель | 12,5—15 % (в пересчёте на активный хлор) |
|
Liquid Bleach |
Hill Brothers Chemical Co. | промышленный отбеливатель и дезинфектант | 10 %; 12,5 % |
|
Clorox Bleach |
The Clorox Company | отбеливатель для прачечных | 6,5—7,35 % |
|
Poolchlor 1 |
Hasa Inc. | жидкость для санитарной обработки бассейнов и спа | 10 % |
Использование для дезинфекции воды
Окислительная дезинфекция с помощью хлора и его производных — едва ли не самый распространённый практический метод обеззараживания воды, начало массового использование которого многими странами Западной Европы , США и Россией датируется первой четвертью XX века :[стр. 17] .
Использование гипохлорита натрия в качестве дезинфицирующего агента взамен хлора является перспективным и обладает рядом существенных преимуществ:
- реагент может быть синтезирован электрохимическим методом непосредственно на месте использования из легкодоступной поваренной соли ;
- необходимые показатели качества питьевой воды и воды для гидротехнических сооружений могут быть достигнуты за счёт меньшего количества активного хлора;
- концентрация канцерогенных хлорорганических примесей в воде после обработки существенно меньше;
- замена хлора на гипохлорит натрия способствует улучшению экологической обстановки и гигиенической безопасности :[стр. 36] .
- гипохлорит обладает более широким спектром биоцидного действия на различные типы микроорганизмов при меньшей токсичности;
Для целей очистки бытовой воды используются разбавленные растворы гипохлорита натрия: типовая концентрация активного хлора в них составляет 0,2—2 мг/л против 1—16 мг/л для газообразного хлора . Разбавление промышленных растворов до рабочей концентрации производят непосредственно на месте.
Также с технической точки зрения, принимая во внимание условие использования в РФ , эксперты отмечают:
- существенно более высокую степень безопасности технологии производства реагента;
- относительную безопасность хранения и транспортировки до места использования;
- лояльные требования к технике безопасности при работе с веществом и его растворами на объектах;
- неподведомственность технологии обеззараживания воды гипохлоритом Ростехнадзору РФ .
Использование гипохлорита натрия для дезинфекции воды в России становится все более популярным и активно внедряется в практику ведущими промышленными центрами страны. Так, в конце 2009 года , в Люберцах началось строительство завода по производству NaOCl мощностью 50 тыс. тонн/год для нужд Московского городского хозяйства. Правительством Москвы было принято решение о переводе систем обеззараживания воды московских станции водоподготовки с жидкого хлора на гипохлорит натрия (с 2012 г.). Завод по производству гипохлорита натрия, переданный Правительством Москвы Акционерному обществу "Мосводоканал", был запущен в эксплуатацию в марте 2015 года: он стал выпускать реагент, необходимый для обеззараживания воды на станциях водоподготовки города Москвы, полностью покрывая их потребности.
Среди других городов и субъектов Российской Федерации , где уже применяется или планируется осуществить переход на гипохлорит натрия для обеззараживания воды, отметим Санкт-Петербург , Ленинградскую область , Кемерово , Ростов-на-Дону , Иваново , Сыктывкар , Севастополь , Новгород , Красноярск .
Производство гидразина
Гипохлорит натрия используется в так называемом ( англ. Raschig Process , окисление аммиака гипохлоритом) — основном промышленном способе получения гидразина , открытого немецким химиком в 1907 году . Химия процесса выглядит следующим образом: на первой стадии аммиак окисляется до хлорамина , который затем, реагирует с аммиаком, образуя собственно гидразин :
Общая схема:
В качестве побочной реакции наблюдается взаимодействие гидразина с хлорамином :
Процесс Рашига протекает в щелочной среде ( pH 8—10) при избытке аммиака, повышенном давлении (2,5—3,0 МПа) и температуре 120—160 °C . Выход гидразина (по гипохлориту) в итоге может достигать 80 % .
Даже незначительные количества катионов некоторых тяжёлых металлов, особенно двухвалентной меди , могут существенно увеличить долю побочной реакции, в связи с чем, в реакционную смесь добавляют небольшое количество желатина или специального клея для связывания ионов в нереакционный комплекс .
Модификацией процесса Рашига стал процесс Хофмана ( англ. Hoffmann Process или англ. Urea Process ), где вместо аммиака используется мочевина :
В процессе используется 43%-й раствор мочевины с добавками специального реагента (приблизительно 0,5 г/л) для ингибирования побочной реакции и увеличения выхода конечного продукта. Раствор гипохлорита натрия используется в соотношении к раствору мочевины, как 4:1; температура в реакторе не превышает 100 °C .
Применение в промышленном органическом синтезе
Сильные окислительные свойства гипохлорита натрия используются в промышленном органическом синтезе для получения различных соединений, среди которых:
- антраниловая кислота — промежуточный продукт в синтезе красителей ;
- — промежуточный продукт в синтезе лекарственных препаратов и электролитов для получения покрытий драгоценными металлами :[стр. 92] :
- хлорпикрин — инсектицид :[стр. 269] ;
- аскорбиновая кислота (синтетическая) — лекарственное средство ( витамин С ) и консервант в пищевой промышленности ;
- и — инсектициды, дезинфектанты и полупродукты для синтеза пестицидов ;
- — пищевая добавка, используемая в качестве загустителя, носителя и улучшителя для хлебопекарных изделий .
Применение в лабораторном органическом синтезе
Гипохлорит натрия находит широкое применение в лабораторной органической практике прежде всего, из-за своих сильных окислительных свойств и доступности как реактива.
Окислительные возможности NaOCl используются в следующих превращениях:
- → диазометан ;
- метилкетоны → карбоновые кислоты (с уменьшением цепи на один атом углерода) ;
- Эта реакция лежит в основе галоформного расщепления и может служить лабораторным методом получения хлороформа или иодоформа :
- α-аминокислоты → альдегиды (с уменьшением цепи на один атом углерода) ;
- первичные амины → нитрилы :[стр. 1518] или карбонильные соединения ;
- галогенуглеводороды → карбоновые кислоты :[стр. 565] ;
- → первичные амины :[стр. 799—800] ;
Среди других вариантов использования отметим:
- реагент (в виде 5%-го водного раствора) для качественного или количественного определения аргинина в смеси аминокислот ( реакция Сакагучи ) ;
- реагент для N-хлорирования аминов :[стр. 819] ;
- реагент для хлорирования ароматических соединений и аллильного хлорирования алкенов ;
- реагент для синтеза органических гипохлоритов .
Прочие направления использования
Среди прочих направлений использования гипохлорита натрия отметим:
- в промышленном органическом синтезе или гидрометаллургическом производстве для дегазации токсичных жидких и газообразных отходов, содержащих циановодород или цианиды ;
- окислитель для очистки сточных вод промышленных предприятий от примесей сероводорода , неорганических , сернистых соединений , фенолов и др. ;
- в электрохимических производствах в качестве травителя для германия и арсенида галлия ;
- в аналитической химии как реагент для фотометрического определения бромид-иона ;
- в пищевой и фармацевтической промышленности для получения пищевого модифицированного крахмала ;
- в военном деле как средство для дегазации боевых отравляющих веществ , таких как иприт , льюизит , зарин и V-газы .
См. также
Комментарии
- ↑ Строго говоря, и « лабарракова вода » и « жавелевая вода » обозначают водные растворы смеси солей ( хлорида и гипохлорита ), соответственно, натрия и калия , что объясняется технологией производства: их получали, пропуская газообразный хлор через водный раствор гидроксида или карбоната щелочного металла. Вместе с тем, хотя исторически название « жавелевая вода » относилась к гипохлориту калия, на практике (в том числе и в литературе) под этим названием нередко фигурирует и гипохлорит натрия.
- Для безводного гипохлорита натрия фазовый переход не удаётся обнаружить из-за разложения соединения.
- В бесконечно разбавленном водном растворе.
-
Несмотря на то, что в настоящей статье используется формула гипохлорита натрия
NaOCl
(натрий не связан с хлором напрямую), в научной литературе фигурирует как формула
NaOCl
, так и
NaClO
, причём последний вариант встречается довольно часто. В настоящей статье использован вариант
NaOCl
, что связано с подобным написанием формулы в специальной литературе последних лет:
- White’s Handbook of Chlorination and Alternative Disinfectants / Black & Veatch Corporation. — 5-th edition. — Hoboken: John Wiley & Sons, 2010. — P. 454. — ISBN 978-0-470-18098-3 .
- Housecroft C. E., Sharpe A. G. . — Third edition. — Edinburgh: Pearson Education Limited, 2007. — P. . — ISBN 978-0-13-175553-6 .
- Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 2: Химия непереходных элементов. — С. 307—308. — ISBN 5-7695-1436-1 .
- ↑ Под «активным хлором» понимается количество хлора, выделяющегося при взаимодействии с HCl . В чистом хлоре содержится 100 % «активного хлора». Содержание «активного хлора» в процентах рассчитывается как отношение массы одного моля хлора (70,9 г) к массе искомого вещества, способного при реакции с HCl выделить один моль хлора (74,5 г для NaOCl).
- До открытия отбеливающих свойств хлора и его производных отбелка ткани представляла собой весьма трудоёмкий и длительный процесс, часто длившийся до восьми недель. Полотно вымачивали в кислом молоке или пахте , а также долго выдерживали под солнцем. Только в 1756 году была совершена первая попытка применить химическое отбеливание для отбеливания ткани: шведский химик Френсис Хоум предложил использовать слабый раствор серной кислоты , сократив время процедуры до 12 часов.
- Приведены значения стандартных электродных потенциалов в водных растворах при температуре 25 °C и давлении 1 атм. Величины потенциалов выражены в вольтах по отношению к стандартному потенциалу водородного электрода, принятому при всех температурах за нуль.
- МДА — метод основан на прибавлении точно измеренного объёма пробы к стандартному раствору определяемого иона, специфически определяемого ионоселективным электродом.
- МУА — метод основан на прибавлении точно измеренной пробы к раствору, содержащему ион, который стехиометрически взаимодействует с определяемым ионом и специфически определяется ионоселективным электродом.
- — патогенная флора мочевых и половых путей.
- Все перечисленные виды — патогенная флора околозубной ткани.
-
Расшифровка обозначений:
- синий цвет — опасность для здоровья;
- красный цвет — пожароопасность;
- жёлтый цвет — химическая активность.
- ↑ Гипохлорит натрия входит в состав средства, согласно данным на упаковке.
- Эндодонтия — раздел стоматологии, занимающийся изучением и лечением системы корневых каналов зуба.
- По данным на 90-е годы XX века в расчёте на брутто-вес (водный раствор гипохлорита).
- Реакция идёт в присутствии катализатора Na 2 Fe(CO) 4 .
Примечания
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп. — М. : Дрофа, 2006. — С. 137. — ISBN 5-7107-8085-5 .
- ↑ Myers R. L. The 100 Most Important Chemical Compounds: A Reference Guide. — Westport: Greenwood Press, 2007. — P. 260. — ISBN 978-0-313-33758-1 .
- ↑ Натрия гипохлорит // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М. : Советская энциклопедия, 1992. — Т. 3. — С. 355. — ISBN 5-85270-039-8 .
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть VI. Растворимость веществ в воде // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп. — М. : Дрофа, 2006. — С. 618. — ISBN 5-7107-8085-5 .
- . Открытие элементов и происхождение их названий . Химическая информационная сеть ChemNet. Дата обращения: 27 января 2010. 20 августа 2011 года.
- Baldwin R. T. (англ.) // Journal of Chemical Education. — 1927. — Vol. 4 , no. 4 . — P. 454 .
- ↑ Ronco C., Mishkin G. J. The Hystory of Hypochlorite // Disinfection by Sodium Hypochlorite: Dialysis Applications. — Contributions to nephrology, vol. 154. — Karger Publishers, 2007. — P. 7—8. — ISBN 978-3-8055-8193-6 .
- Drinking Water and Health / Assembly of Life Sciences, Safe Drinking Water Committee. — Washington: National Press Academy, 1980. — P. 18. — ISBN 978-030902931-5 .
- . Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений . ChemAnalytica.com. Дата обращения: 25 января 2010. 20 августа 2011 года.
- ↑ Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 870—871. — ISBN 0-07-049439-8 .
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть VII. Плотность воды и водных растворов. Глава 3. Соли // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп. — М. : Дрофа, 2006. — С. 657. — ISBN 5-7107-8085-5 .
- ↑ White’s Handbook of Chlorination and Alternative Disinfectants / Black & Veatch Corporation. — 5-th edition. — Hoboken: John Wiley & Sons, 2010. — P. 452—571. — ISBN 978-0-470-18098-3 .
- ↑ Гипохлориты // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М. : Советская энциклопедия, 1988. — Т. 1. — С. 1121—1122.
- Турова Н. Я. Неорганическая химия в таблицах. — М. : Высший химический колледж РАН, 1997. — С. 6.
- ↑ . ООО ФСП «Кравт». Дата обращения: 29 января 2010. 20 августа 2011 года.
- Ахметов Н. С. Общая и неорганическая химия. Учебник для вузов. — 4-е изд., исправленное. — М. : Высшая школа, 2001. — С. 326. — ISBN 5-06-003363-5 .
- . Новый справочник химика и технолога. Электродные процессы. Химическая кинетика и диффузия. Коллоидная химия . ChemAnalytica.com. Дата обращения: 25 января 2010. 20 августа 2011 года.
- ↑ Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 2: Химия непереходных элементов. — 368 с. — ISBN 5-7695-1436-1 .
- Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 3, Книга 1: Химия переходных элементов. — 352 с. — ISBN 5-7695-2532-0 .
- Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 3, Книга 2: Химия переходных элементов. — 400 с. — ISBN 5-7695-2533-9 .
- Фрумина Н. С., Лисенко Н. Ф., Чернова М. А. Хлор. — Серия: Аналитическая химия элементов. — М. : Наука, 1983. — С. 25.
- . Новый справочник химика и технолога. Аналитическая химия (часть I) . ChemAnalytica.com. Дата обращения: 25 января 2010. 20 августа 2011 года.
- Иодометрия // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М. : Советская энциклопедия, 1990. — Т. 2. — С. 496—497. — ISBN 5-85270-035-5 .
- . Новый справочник химика и технолога. Электродные процессы. Химическая кинетика и диффузия. Коллоидная химия . ChemAnalytica.com. Дата обращения: 25 января 2010. 20 августа 2011 года.
- Швецов А. Б., Козырева А. В., Седунов С. Г., Тараскин К. А. Хлорные дезинфектанты и их применение в современной водоподготовке // Молекулярные технологии. — 2009. — № 3 . — С. 98—121 .
- Бахир В. М. Оптимальный путь повышения промышленной и экологической безопасности объектов водоподготовки и водоотведения ЖКХ // Питьевая вода. — 2007. — № 6 . — С. 4—15 .
- Ingle J. I., Bakland L. K., Baumgartner J. C. Ingle’s Endodontics 6. — 6. — BC Deker, 2008. — P. 998—999. — ISBN 978-1-55099-333-9 .
- / World Health Organization. — London: IWA Publishing, 2004. — P. 45. — ISBN 1-84339-069-8 . 24 сентября 2013 года.
- / Edited by Fleming D. O., Hunt D. L.. — Third edition. — Washington: ASM Press, 200o. — P. . — ISBN 1-55581-180-9 .
- (англ.) (PDF). Managing Hazardous Materials Incidents (MHMIs) . Agency for Toxic Substances and Disease Registry. Дата обращения: 28 января 2010. 20 августа 2011 года.
- ↑ Fletcher J., Ciancon D. (англ.) . Environmental Science and Engineering Magazine (May, 1996). Дата обращения: 30 января 2010. 20 февраля 1997 года.
- ↑ (англ.) . Chemical and Other Safety Information . The Physical and Theoretical Chemistry Laboratory Oxford University. Дата обращения: 1 февраля 2010. 21 августа 2011 года.
- (англ.) (PDF). Department of Emergency Services, County of Sonoma (10 января 2009). Дата обращения: 28 января 2010. 4 августа 2009 года.
- ↑ Губер Ф., Шмайсер М., Шенк П. В., Фехер Ф., Штойдель Р., Клемент Р. Руководство по неорганическому синтезу: в 6 томах / Пер. с немецкого / Под редакцией Г. Брауэра. — М. : Мир, 1985. — Т. 2. — С. 355—356.
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под ред. проф. Н. В. Лазарева и проф. И. Д. Гадаскиной. — Издание 7-е, пер. и доп. — Л. : Химия, 1977. — Т. 3. — С. 44.
- Крамаренко В. Ф. Токсикологическая химия. — Киев: Выща школа, 1989. — С. 426. — ISBN 5-11-000148-0 .
- . www.creon-conferences.com . Дата обращения: 16 декабря 2020. 20 октября 2020 года.
- Ronco C., Mishkin G. J. Production of Sodium Hypochlorite // Disinfection by Sodium Hypochlorite: Dialysis Applications. — Contributions to nephrology, vol. 154. — Karger Publishers, 2007. — P. 9. — ISBN 978-3-8055-8193-6 .
- ↑ Handbook of Detergents, Part F: Production / Edited by Uri Zoller, co-editor Paul Sosis. — Surfactant Science Series. — CRC Press, 2009. — 593 p. — ISBN 978-0-8247-0349-3 .
- . ЗАО «Каустик». Дата обращения: 12 февраля 2010. 12 марта 2010 года.
- . ОАО «Каустик». Дата обращения: 12 февраля 2010. 20 августа 2011 года.
- . ЗАО «НПО Реагенты». Дата обращения: 12 февраля 2010. Архивировано из 20 августа 2011 года.
- ↑ Ratnayaka D. D., Brandt M. J., Johnson M. Twort’s Water Supply. — 6-th edition. — Oxford: Butterworth-Heinemann, 2009. — P. 439—441. — ISBN 978-0-7506-6843-9 .
- Bommaraju T. V., Orosz P. J., Sokol E. A. (англ.) . YCES — Case Western Reserve University. Дата обращения: 11 февраля 2010. 20 августа 2011 года.
- (англ.) . Severn Trent De Nora. Дата обращения: 11 февраля 2010. 20 августа 2011 года.
- (англ.) . Severn Trent De Nora. Дата обращения: 11 февраля 2010. 20 августа 2011 года.
- (англ.) . Severn Trent De Nora. Дата обращения: 11 февраля 2010. 20 августа 2011 года.
- (англ.) . Severn Trent De Nora. Дата обращения: 11 февраля 2010. 20 августа 2011 года.
- ↑ ГОСТ 11086-76. Гипохлорит натрия. Технические условия. — Издание официальное. — М. : Стандартинформ, 2008. — 7 с.
- ↑ (англ.) . Chemical Economics Handbook . IHS (июль 2012). Дата обращения: 13 августа 2014. 13 августа 2014 года.
- Technology Economics: Sodium Hypochlorite Chemical Production. — Intratec Solutions, 2013. — P. 62. — ISBN 978-1-483-95119-5 .
- ↑ Weisblatt J. Sodium Hypochlorite // Chemical Compounds / Project editor Charles B. Montney. — Thomson Gale, 2006. — P. 759—763. — ISBN 1-4144-0150-7 .
- . ОАО «Саянскхимпласт». Дата обращения: 5 августа 2017. 20 августа 2011 года.
- (англ.) . The Clorox Company. Дата обращения: 7 сентября 2015. 20 августа 2011 года.
- (англ.) (PDF). The Clorox Company. Дата обращения: 31 января 2010. 20 августа 2011 года.
- (англ.) (PDF) (недоступная ссылка — ) . Procter & Gamble Company. Дата обращения: 3 февраля 2010.
- ↑ (англ.) . Sunbelt Chemicals Corp. Дата обращения: 27 января 2010. 20 августа 2011 года.
- [drugs-about.com/drugs-l/lysol-brand-disinfectant-bleach-toilet-bowl-cleaner.html Lysol Brand Disinfectant Bleach Toilet Bowl Cleaner] (англ.) . Pharmaceutical and Healthcare Online Databases Drugs-About.com. Дата обращения: 28 января 2010. 20 августа 2011 года.
- ↑ Кантаторе Д. . Денталсайт (апрель 2004). Дата обращения: 29 января 2010. Архивировано из 14 марта 2006 года.
- Бурбелло А. Т., Шабров А. В. Современные лекарственные средства: Клинико-фармакологический справочник практического врача. — 4-е издание, переработанное и дополненное. — М. : Олма Медиа Групп, 2007. — С. 396. — ISBN 978-5-373-01525-7 .
- ↑ . Справочник лекарств РЛС . Регистр лекарственных средств России РЛС. Дата обращения: 28 января 2010. 10 октября 2012 года.
- Fouad A. F. . — Wiley-Blackwell, 2009. — P. 33. — ISBN 978-0-8138-2646-2 .
- . Сайт врача Мязина Р. Г.. Дата обращения: 28 января 2010. 1 декабря 2011 года.
- Мельников Н. Н. Пестициды. Химия, технология и применение. — М. : Химия, 1987. — С. 671.
- . Новый справочник химика и технолога. Сырье и продукты промышленности органических и неорганических веществ (часть II) . ChemAnalytica.com. Дата обращения: 25 января 2010. 29 апреля 2014 года.
- Ковернинский И. Н., Комаров В. И., Третьяков С. И., Богданович Н. И., Соколов О. М., Кутакова Н. А., Селянина Л. И. Комплексная химическая переработка древесины / Под редакцией проф. И. Н. Ковернинского. — Архангельск: Издательство Архангельского государственного технического университета, 2002. — С. 81. — ISBN 5-261-00054-3 .
- Синтетические моющие средства // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1995. — Т. 4. — С. 700. — ISBN 5-85270-092-4 .
- . dondez.ru. Дата обращения: 7 сентября 2015. 4 марта 2016 года.
- (недоступная ссылка — ) . ДНПК «Альфа». Дата обращения: 4 февраля 2010.
- . STEK-WT. Дата обращения: 17 марта 2016. 23 марта 2016 года.
- . ООО «Аква-Кемикал». Дата обращения: 24 июня 2013. 9 декабря 2007 года.
- . Kemira oyj. Дата обращения: 16 марта 2013. 16 марта 2013 года.
- . ООО «Макропул Кемиклс». Дата обращения: 16 февраля 2010. 20 августа 2011 года.
- (англ.) (PDF). Harvard Chemical Research. Дата обращения: 12 февраля 2010. 20 августа 2011 года.
- (англ.) . Hill Brothers Chemical Co. Дата обращения: 30 января 2010. 20 августа 2011 года.
- (англ.) (PDF). The Clorox Company. Дата обращения: 31 января 2010. 20 августа 2011 года.
- (англ.) (PDF). Hasa Inc. Дата обращения: 2 февраля 2010. 20 августа 2011 года.
- ↑ Кузубова Л. И., Кобрина В. Н. Химические методы подготовки воды (хлорирование, озонирование, фторирование): Аналитический обзор. — Новосибирск: СО РАН, ГННТБ, НИОХ, 1996. — Т. Выпуск 42. — 132 с. — (серия «Экология»).
- Spellman F. R. Handbook of Water and Wastewater Treatment Plant Operations. — Second Edition. — Бока-Ратон: CRC Press, Taylor & Francis Group, 2009. — P. 647. — ISBN 978-1-4200-7530-4 .
- . Технологическое бюро инженера Шапиро А. С. «ЦентрХлорРеконструкция». Дата обращения: 29 января 2010. Архивировано из 10 ноября 2011 года.
- Белоусов К.В. . «Рекон СПб». Дата обращения: 15 марта 2013. 16 марта 2013 года.
- Зорина С. // Российская газета. — 30 июня 2009. — № 4941 .
- . «Макропул Кемиклс». Дата обращения: 29 января 2010. 20 августа 2011 года.
- . ООО «НПП Экофес». Дата обращения: 16 апреля 2010. Архивировано из 8 сентября 2013 года.
- . ОАО «Водоканал». Дата обращения: 16 апреля 2010. 20 августа 2011 года.
- . МУП «Сыктывкарский водоканал». Дата обращения: 16 апреля 2010. Архивировано из 4 марта 2016 года.
- (13 октября 2016). Дата обращения: 13 октября 2016. 16 октября 2016 года.
- . Городская еженедельная газета НОВГОРОД . 2018-06-26. из оригинала 26 июня 2018 . Дата обращения: 26 июня 2018 .
- ↑ Lawrence S. A. Amines: Synthesis, Properties and Applications. — Cambridge: Cambridge University Press, 2004. — P. 176—177. — ISBN 0-521-78284-8 .
- Гидразин // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1988. — Т. 1. — С. 1070—1071.
- ↑ Hydrazine and Derivatives // Kirk-Othmer Encyclopedia of Chemical Technology. — 4-th edition. — New York: John Wiley & Sons, 1994. — P. 281—282.
- ↑ Maxwell G. R. Synthetic Nitrogen Products: A Practical Guide to the Products and Processes. — New York: Kluwer Academic / Plenum Publishers, 2004. — P. 342. — ISBN 0-306-48225-8 .
- Антраниловая кислота // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1988. — Т. 1. — С. 348.
- ↑ Szmant H. H. Organic Building Blocks of the Chemical Industry. — John Wiley & Sons, 1989. — 716 p. — (0-471-85545-6).
- Шнайдман Л. О. Производство витаминов. — М. : Пищевая промышленность, 1973. — С. 274—275.
- Meslah R. N. (англ.) (PDF). FreePatentsOnline.com (6 июня 1972). Дата обращения: 30 января 2010. 20 августа 2011 года.
- Сарафанова Л. А. Пищевые добавки: Энциклопедия. — 2-е изд., испр. и доп. — СПб. : ГИОРД, 2004. — С. 346−347. — 808 с. — ISBN 5-901065-79-4 .
- Физер Л., Физер М. Реагенты для органического синтеза / Пер. с англ., под редакцией акад. И. Л. Кнунянца и докт. хим. наук Р. Г. Костяновского. — М. : Мир, 1970. — Т. 2. — С. 407.
- ↑ Smith M. B., March J. March’s advanced organic chemistry: reactions, mechanisms, and structure. — 5-th edition. — New York: John Wiley & Sons, 2001. — 2083 p. — ISBN 0-471-58589-0 .
- ↑ Hudlický M. Oxidation in Organic Chemistry. — ACS monograph 186. — Washington: American Chemical Society, 1990. — P. 27. — ISBN 0-8412-1780-7 .
- Li J. J., Limberakis C., Pflum D. A. Modern Organic Synthesis in the Laboratory: A Collection of Standard Experimental Procedures. — New York: Oxford University Press, 2007. — P. 69. — ISBN 978-0-19-518798-4 .
- Bright Z. R., Luyeye C. R., Morton A. Ste. M., Sedenko M., Landolt R. G., Bronzi M. J., Bohovic K. M., Gonser M. W. A., Lapainis T. E., Hendrickson H. W. (англ.) // The Journal of Organic Chemistry. — 2005. — Vol. 70 , no. 2 . — P. 684—687 .
- Галоформная реакция // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1988. — Т. 1. — С. 970—971.
- Ogata Y., Kimura M., Kondo Y. (англ.) // Bulletin of the Chemical Society of Japan. — 1981. — Vol. 54 , no. 7 . — P. 2057—2060 .
- Сульфоксиды // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1995. — Т. 4. — С. 926. — ISBN 5-85270-092-4 .
- Wood A. E., Travis E. G. (англ.) // Journal of the American Chemical Society. — 1928. — Vol. 50 , no. 4 . — P. 1226—1228 .
- Сакагучи реакция // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1995. — Т. 4. — С. 568. — ISBN 5-85270-092-4 .
- Hopkins C. Y., Chisholm M. J. [www.erowid.org/archive/rhodium/chemistry/5-chlorovanillin.hypochlorite.html Chlorination by Aqueous Sodium Hypochlorite] (англ.) . Can. J. Res. B, 24, 208 (1946) . Rhodium site archive. Дата обращения: 30 января 2010. 20 августа 2011 года.
- Moreno-Dorado F. J., Guerra F. M., Manzano F. L., Aladro F. J., Jorge Z. D., Massanet G. M. (англ.) // Tetrahedron Letters. — 2003. — Vol. 44 , no. 35 . — P. 6691—6693 .
- Общая органическая химия. Кислородсодержащие соединения = Comprehensive Organic Chemistry / Под ред. Д. Бартона и В. Д. Оллиса. — М. : Химия, 1982. — Т. 2. — С. 62—63.
- (англ.) . Chlorine and chlorine compounds . BASF. The Inorganics Division. Дата обращения: 25 января 2010. 20 августа 2011 года.
- Охрана природы. Очистка сточных вод // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1992. — Т. 3. — С. 860. — ISBN 5-85270-039-8 .
- . Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность . ChemAnalytica.com. Дата обращения: 25 января 2010. 20 мая 2010 года.
- . Новый справочник химика и технолога. Аналитическая химия (часть III) . ChemAnalytica.com. Дата обращения: 25 января 2010. 26 июня 2010 года.
- Крахмал // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1990. — Т. 2. — С. 988—989. — ISBN 5-85270-035-5 .
- Иприт // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1990. — Т. 2. — С. 533. — ISBN 5-85270-035-5 .
- Льюизит // Химическая энциклопедия / И. Л. Кнунянц. — М. : Советская энциклопедия, 1990. — Т. 2. — С. 1215—1216. — ISBN 5-85270-035-5 .
- Франке З., Франц П., Варнке В. Химия отравляющих веществ / Пер. с нем., под редакцией акад. И. Л. Кнунянца и д-ра хим. наук Р. Н. Стерлина. — М. : Химия, 1973. — Т. 2. — С. 333—336.
Литература
- Бахир В. М., Леонов Б. И., Паничева С. А., Прилуцкий В. И., Шомовская Н. Ю. // Вестник новых медицинских технологий. — 2003. — № 4 .
- Беляк А. А., Касаткина А. Н., Гонтовой А. В., Смирнов А. Д., Привен Е. М., Благова О. Е. К вопросу об использовании растворов гипохлорита натрия в водоподготовке // Питьевая вода. — 2007. — № 2 . — С. 25—34 .
- Моргуль Т. Г., Гальченко Л. И., Бублик Ю. Н., Колесник А. Р. // Чистота воды и здоровье. — 2003.
- Перова М. Д., Петросян Э. А., Банченко Г. В. Гипохлорит натрия и его использование в стоматологии // Стоматология. — 1989. — № 2 . — С. 84—87 .
- Фурман Л. А. Глава 3. Гипохлорит натрия // Хлорсодержащие окислительно-отбеливающие и дезинфицирующие вещества. — М. : Химия, 1976. — С. 48—57.
- Эвентов В. Л., Андрианова М. Ю., Кукаева Е. А. Детоксикация и дезинфекция гипохлоритом натрия // Медицинская техника. — 1998. — № 6 . — С. 36—39 .
- Casson L., Bess J. Conversion to On-Site Sodium Hypochlorite Generation: Water and Wastewater Applications. — CRC Press, 2002. — 224 p. — ISBN 978-158716094-3 .
- Chartier R. A. Bleaching Agents. Sodium Hypochlorite // Encyclopedia of Chemical Processing and Design: Volume 4 — Asphalt Emulsion to Blending / Edited by John J. McKetta, William A. Cunningham. — New York: Marcel Dekker, Inc, 1977. — P. 434—437. — ISBN 0-824-72454-2 .
- Ronco C., Mishkin G. J. Disinfection by Sodium Hypochlorite: Dialysis Applications. — Contributions to nephrology, vol. 154. — Karger Publishers, 2007. — 157 p. — ISBN 978-3-8055-8193-6 .
- Rutala W. A., Weber D. J. (англ.) // Clinical Microbiology Reviews. — 1997. — Vol. 10 , no. 4 . — P. 597—610 .
- Weisblatt J. Sodium Hypochlorite // Chemical Compounds / Project editor Charles B. Montney. — Thomson Gale, 2006. — P. 759—763. — ISBN 1-4144-0150-7 .
- White’s Handbook of Chlorination and Alternative Disinfectants / Black & Veatch Corporation. — 5-th edition. — Hoboken: John Wiley & Sons, 2010. — P. 452—571. — ISBN 978-0-470-18098-3 .
Ссылки
- . ООО «Макропул Кемиклс». Дата обращения: 16 февраля 2010. 20 августа 2011 года.
- (англ.) (PDF). (1997). Дата обращения: 3 февраля 2010. 20 августа 2011 года.
- (англ.) . . Дата обращения: 12 февраля 2010. 20 августа 2011 года.
- (англ.) (PDF). (2008). — Version 2. Дата обращения: 3 февраля 2010. 20 августа 2011 года.
|
|
Некоторые
внешние ссылки
в этой статье
ведут на сайты, занесённые в
спам-лист
|
- 2021-12-15
- 1