Алоэ
- 1 year ago
- 0
- 0

Хромо́н (или бензо-4-пиро́н ) — гетероциклическое органическое соединение, производное бензопирана с кето-группой в положении 4 пиранового кольца. Хромон является основой структуры флавоноидов ; кроме того, производные хромона, не являющиеся флавоноидами, распространены в растительном и бактериальном мирах. Хромон считается перспективным структурным блоком для поиска новых фармацевтических субстанций.
Название «хромон» было впервые использовано М. Блохом и С. Костанецким для описания окрашенных природных соединений, содержащих в структуре бензопиран-4-оновый фрагмент. Незамещенный хромон был впервые получен С. Руэманном и Х. Стэплтоном в 1900 году пиролизом 2-хромонкарбоновой кислоты, полученной, в свою очередь, ими же из феноксифумаровой кислоты.
В УФ спектре хромона наблюдаются максимумы поглощения при 245 (ɛ=10000) и 297 (ɛ=6460) нм, в ИК-спектрах хромона валентным колебаниям карбонильной группы соответствует полоса поглощения 1660 см −1 . Большинство хромонов флуоресцируют в УФ-свете желтым или желто-зеленым цветом. Интенсивность флуоресценции усиливается под воздействием паров аммиака или после обработки спиртовыми растворами щелочей. В отличие от кумаринов, хромоны усиливают флуоресценцию в УФ-свете после обработки серной кислотой.
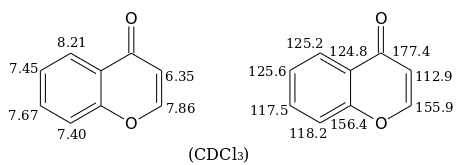
В спектрах ЯМР 1 H и 13 С хромона в дейтерохлороформе наблюдаются следующие сигналы (в миллионных долях):
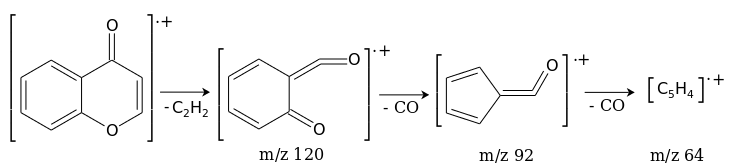
В масс-спектре хромона, помимо молекулярного иона М +. с m/z 146, наблюдаются пики продуктов фрагментации, сопровождающейся выбросом молекулы ацетилена, а затем двух молекул СО в соответствии со схемой:
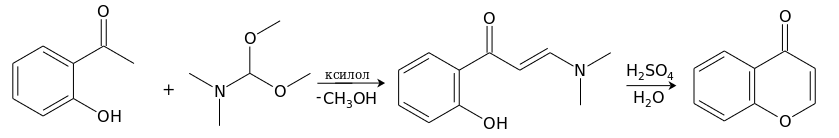
Удобный метод получения хромона основан на реакции о-гидроксиацетофенона с диметилацеталем диметилформамида в кипящем ксилоле с одновременной отгонкой образующегося метанола. Получающийся енаминокетон под действием водного раствора серной кислоты при 100°С циклизуется в хромон.
Исторически, для получения 2- и 3-замещенных хромонов также широко распространены методы синтеза путем конденсаций с использованием производных о-гидроксиацетофенона, но к настоящему времени известно и множество других подходов к их синтезу. Большое значение сохраняют и
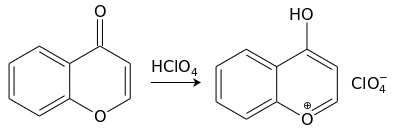
С сильными кислотами (например, хлорной) хромон образует (хромилия) лимонно-желтого цвета:
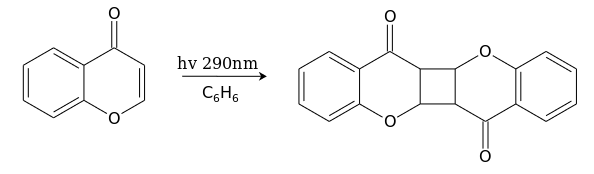
При облучении УФ светом бензольного раствора хромона он димеризуется, образуя продукт типа «голова-к-хвосту»:
Хромон довольно легко вступает в реакции со многими нуклеофилами. Эти реакции чаще всего протекают по положению С(2) и сопровождаются раскрытием пиронового кольца. Так, холодный раствор гидроксида натрия обратимо превращает хромоны в соли соответствующих ациклических производных фенола в результате атаки по положению С(2). Продукты реакций с концентрированными щелочами обычно окрашены в пурпурно-красный цвет.
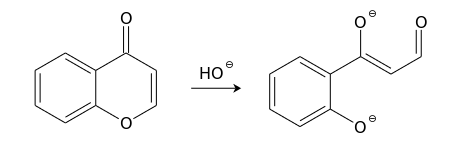
В более жестких условиях наблюдается разрушение 1,3-дикарбонильного бокового фрагмента такого производного фенола (превращение, обратное конденсации Клайзена ).
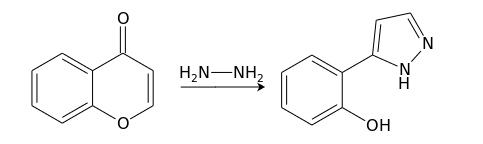
Взаимодействие с бинуклеофилами, например, гидразином , протекает через атаку по положению С(2), дециклизацию, и вторичную атаку по С(4) с формированием 5-замещенного пиразола :
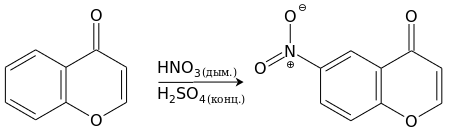
Хромон труднее вступает в реакции с реагентами электрофильной природы, и они почти всегда проходят, не затрагивая пироновый фрагмент. Нитрование хромона дымящей азотной кислотой в присутствии концентрированной серной кислоты приводит с хорошим выходом к 6-нитрохромону.
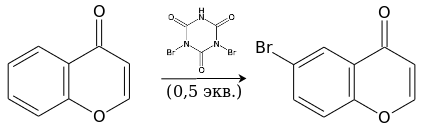
Бромирование дибромизоциануровой кислотой идёт уже при комнатной температуре и также приводит к 6-замещённому производному.
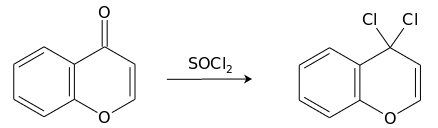
Реакцией хромона с тионилхлоридом может быть получен продукт замещения кислорода кето-группы.
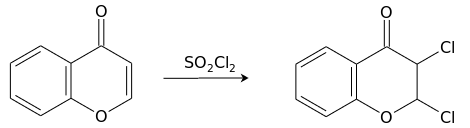
Взаимодействие с сульфурилхлоридом приводит к продукту присоединения хлора по двойной связи пиронового кольца, 2,3-дихлорхроманону.
Производные хромона от производных кумарина отличают при помощи реакции азосочетания , например с диазотированной сульфаниловой кислотой. Хотя хромоны в фильтрованном ультрафиолетовом свете характеризуются сходной с некоторыми кумаринами флуоресценцией, с диазореагентами они образуют в растворах светло-желтое окрашивание, а на бумаге этой реакции вообще не обнаруживается, в то время как продукты взаимодействия кумаринов с солями диазония имеют устойчивую окраску, которая, в зависимости от строения кумарина и диазореагента, может меняться от оранжевой до красной. В отличие от флавоноидов, хромоны не дают окраски со смесью борной и лимонной кислот.
При взаимодействии с 0,1 % водным раствором уранилацетата хромоны, в зависимости от структуры, образуют окрашенные растворы (оранжевые, красные, фиолетовые) или желтый осадок.
Замещенные хромоны широко распространены в природе. В течение суток с растительными продуктами человек потребляет около 140—190 мг различных производных хромона, главным образом, флавоноидов . Многие флавоноиды, а также производные хромона, выделенные из растений и низших грибов, обладают противоопухолевой, фунгицидной, антиоксидантной, Р-витаминной и др. видами биологической активностьи. Синтетические производные хромона также используются в качестве фармпрепаратов.
{{
cite journal
}}
:
Недопустимый
|display-authors=4
(
справка
)
{{
cite journal
}}
:
Недопустимый
|display-authors=2
(
справка
)
{{
cite journal
}}
:
Недопустимый
|display-authors=4
(
справка
)
{{
cite journal
}}
:
Недопустимый
|display-authors=2
(
справка
)
{{
cite journal
}}
:
Недопустимый
|display-authors=2
(
справка
)
{{
cite journal
}}
:
Недопустимый
|display-authors=3
(
справка
)