Трихлори́д бо́ра
(
хлорид бора(+3), хлорид бора(III), трёххлористый бор
,
хим. формула
—
BCl
3
) —
бинарное
неорганическое
соединение
бора
и
хлора
. Представляет собой бесцветный
газ
с резким неприятным
запахом
, реагирует с
водой
.
Ядовит
.
Физические свойства
При
стандартных условиях
трихлорид бора BCl
3
представляет собой
ядовитый
, тяжёлый бесцветный газ, вследствие взаимодействия с парами воды дымящийся во влажном воздухе.
При
нормальных условиях
— это жидкость, давление пара которой описывается уравнением:
-

В твёрдом состоянии трихлорид бора образует кристаллы
гексагональной сингонии
,
пространственная группа
P6
3
,
a
=0,6140 нм,
c
= 0,6603 нм, Z = 9.
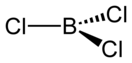
Молекула трихлорида бора представляет собой правильный треугольник (как и другие
тригалогениды
бора) с длиной связи B—Cl 0,175 нм. Вследствие тригональной симметрии молекула имеет нулевой дипольный момент.
Трихлорид бора
не образует
димеры
, хотя есть косвенные свидетельства того, что он может образовывать димеры при очень низких температурах (20
К
).
Получение
Трихлорид бора можно синтезировать из элементов:
-

В промышленности вместо чистого бора используют его сплавы, например
ферробор
.
Также в промышленности используют метод хлорирования при температуре ~1000 °C смеси
оксида бора
и
кокса
:
-

В России используется промышленный метод хлорирования карбида бора при температуре 900—1000 °C:
-

Трихлорид алюминия и трифторид бора могут обмениваться галогенами:
-

В лабораторной практике трихлорид бора получают разложением его аддуктов, например, BCl
3
S(СН
3
)
2
, которые удобны в работе, так как являются твёрдыми веществами:
-

Химические свойства
Полностью гидролизуется водой с выделением большого количества тепла:
-

Реагирует с разбавленными и концентрированными щелочами:
-

-
![{\displaystyle {\mathsf {BCl_{3}+4NaOH\rightarrow Na[B(OH)_{4}]+3NaCl}}}](/images/005/659/5659229/15.jpg?rand=690430)
Восстанавливается водородом до бора или
борана
:
-

-

Горит в кислороде (на воздухе при температуре >400 °C):
-

Фтор вытесняет хлор из соединения:
-

Трихлорид бора является
кислотой Льюиса
, которая образует
аддукты
с третичными
аминами
,
фосфинами
,
эфирами
,
тиоэфирами
и
:
-

Реагирует с оловоорганическими соединениями:
-

При пропускании через трихлорид бора электрической искры получаются низшие хлориды бора B
2
Cl
6
, B
4
Cl
4
, B
8
Cl
8
:
-

Реагирует со спиртами с образованием эфиров-боратов:
-

При нагревании реагирует с борным ангидридом с образованием оксихлорида бора:
-

Металлы могут восстанавливать трихлорид бора до бора или образовывать бориды:
-

-

Применение
Трихлорид бора — едкое, весьма токсичное вещество
, обладающее удушающим действием
.
ПДК
в рабочей зоне — 1 мг/м³,
0,3 мг/л•1 мин.
См. также
Примечания
-
name=
(недоступная ссылка)
12.1.007-76. Система стандартов безопасности труда (ССБТ). Вредные вещества. Классификация и общие требования безопасности (с Изменениями N 1, 2)
-
(англ.)
: A CRC quick reference handbook
—
CRC Press
, 1993. —
ISBN 978-0-8493-4498-5
-
name=
(недоступная ссылка)
бора
-
name=
(недоступная ссылка)
Литература
-
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. —
М.
: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.