Interested Article - Гидрид-ион

- 2021-10-07
- 1

Гидрид-ион, отрицательно заряженный ион водорода, H - — физическая система, состоящая из одного протона и двух электронов . Два электрона создают электронную оболочку гидрид-иона, электронная конфигурация которой 1s 2 . Иначе говоря, ядро гидрид-иона окружает двухэлектронное облако с антипараллельными спинами электронов . Образование гидрид-иона описывается физической моделью ударной ионизации атома водорода электроном. Ионизация обусловлена захватом атомом водорода дополнительного электрона с образованием отрицательно заряженного иона водорода и высвобождением энергии:
Электрон, обладая отрицательным элементарным электрическим зарядом (q = 1,6 · 10 −19 Кл), создаёт электрическое поле с напряжённостью
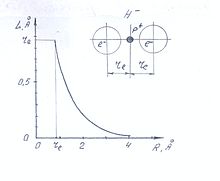
Напряжённость электрического поля на расстоянии R от заряда около 10 Å составляет десятки миллионов вольт на сантиметр . Это электрическое поле приводит к деформационной поляризации нейтрального атома водорода, попадающего в электрическое поле электрона. Центр электронной оболочки атома водорода смещается относительно ядра на некоторое расстояние L в противоположную сторону к приближающемуся электрону. Приближающийся электрон как бы вытесняет из атома водорода находящийся в нём электрон. Деформация приводит к появлению в атоме водорода наведённого дипольного момента μ.
Величина смещения центра электронной оболочки атома водорода L обратно пропорциональна квадрату расстояния атома водорода к приближающемуся электрону R:
Поскольку электронная поляризуемость атома водорода α e = 0,66Å , то
-
- (рис.1)
Сближение атома водорода и электрона возможно до тех пор, пока центры областей плотностей вероятности нахождения обоих электронов не станут равноудалёнными от ядра объединённой системы — отрицательно заряженного иона водорода. Такое состояние системы имеет место при
где r e — орбитальный радиус двухэлектронной оболочки гидрид-иона H - .
Ионные структуры, содержащие в своём составе гидрид-ион H - , известны. Соединения этого типа образуются прямым взаимодействием наиболее активных металлов (Na, Ca и др.) с водородом при нагревании. По своему характеру они являются типичными солями. Все гидриды щелочных металлов ( гидрид лития , гидрид натрия , гидрид калия , гидрид цезия ) образуют кристаллическую структуру с кубической сингонией . Их расплавы высоко электропроводны, при электролизе расплавленных гидридов водород выделяется на аноде.
Гидрид-ион H - является промежуточным звеном при гидрировании органических соединений по кратным связям, дегидрировании углеводородов , в реакциях Чичибабина , Соммле и др. Гидрид-ион H - образуется также при бомбардировке молекул воды электронами .
Гидрид-ион H - является донором электронной пары в донорно-акцепторном механизме образования ковалентной химической связи , например
Присоединение гидрид-иона к молекуле BH 3 приводит к образованию сложного (комплексного) иона BH 4 - :
См. также
Примечания
- Ахметов Н. С. Неорганическая химия. — 2-е изд., перераб. и доп., с илл. — М. : «Высшая школа», 1975. — 672 с.
- Некрасов Б. В. Курс общей химии. — М. : Госхимиздат, 1962. — 976 с.
- Справочник химика. — 2-е изд., перераб. и доп. — М. - Л. : Издательство химической литературы, 1962. — С. 385. — 1071 с.
- / гл.редактор И. Л. Кнунянц. — М. : Советская энциклопедия, 1983. — С. . — 792 с.
- 2021-10-07
- 1





![{\displaystyle {\mathsf {r_{e}=L=R={\sqrt[{3}]{0,66}}=0,871A}}}](/images/005/677/5677385/7.jpg?rand=728152)

![{\displaystyle {\mathsf {BH_{3}+H^{-}\rightarrow [BH_{4}]^{-}}}}](/images/005/677/5677385/9.jpg?rand=926703)