Электрохимический градиент
- 1 year ago
- 0
- 0

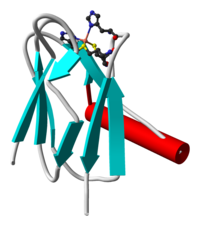
Пластоцианин — медьсодержащий белок , вовлечённый в транспорт электронов от фотосистемы II к фотосистеме I . Этот мономерный белок, состоящий у большинства сосудистых растений из 99 аминокислот , имеет молекулярную массу около 10,5 к Да . Он является представителем пластоцианинового семейства медьсвязывающих белков .
В фотосинтезе пластоцианин играет роль переносчика электронов от цитохрома f из цитохром- b 6 /f -комплекса к P700 + из фотосистемы I . Цитохром- b 6 /f -комплекс и фотосистема I — это заякоренные в мембране белковые комплексы , активные центры которых расположены на люмиальной стороне мембраны тилакоида . Цитохром f является донором электронов, в то время как P700 + принимает электрон от восстановленного пластоцианина.
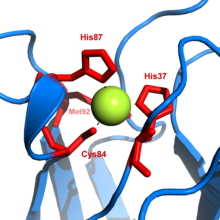
Пластоцианин был первым из медьсодержащих белков, структура которого была расшифрована при помощи рентгеноструктурного анализа . Его третичная структура — это бета-бочка, характерная для белков, которые связываются с другими белками . Хотя третичная структура молекулы пластоцианина различна для высших растений , водорослей и цианобактерий , структура медь-связывающего сайта крайне консервативна. Обычно его описываю как «искаженную тригональную пирамиду», основание которой состоит из двух атомов азота (N 1 и N 2 ) от двух гистидинов и атома серы (S 1 ) из цистеина . Вершину пирамиды формирует атом серы (S 2 ) из осевого метионина . «Искажение» происходит по длине связи между медью и серосодержащими лигандами : связь Cu-S 1 короче (207 пикометров ) чем Cu-S 2 (282 пикометров). Удлинённая связь Cu-S 2 дестабилизирует Cu II и увеличивает редокс-потенциал белка. Голубая окраска белка (пик поглощения 597 нм ) объясняется влиянием связи Cu-S 1 где происходит перенос заряда от S pπ к Cu dx 2 -y 2 .
Когда пластоцианин восстановлен, His -87 становится протонированным с pK a = 4,4. Протонирование заставляет его отделится от атома меди и сайт связывания становится плоским треугольником.
Хотя поверхность молекулы пластоцианина рядом с медь-связывающим сайтом может различаться, все пластцианины имеют гидрофобную поверхность, окружающую неприкрытый гистидин, образующий связь с медью. В растительных пластоцианинах по обе стороны от высококонсервативного тирозина -83 располагаются кислотные остатки. Пластоцианины водорослей и сосудистых растений из семейства сельдерейных обладают схожими кислотными остатками, но отличаются от растительных пластоцианинов по форме — у них отсутствуют 57-й и 58-й аминокислотные остатки. У цианобактерий распределение заряженных аминокислотных остатков по поверхности белка отличается от эукариотических пластоцианинов, а их структура может сильно отличаться у разных видов бактерий. У многих цианобактерий пластоцианин состоит из 107 аминокислотных остатков. Хотя кислотные участки у бактерий не консервативны, всегда присутствует гидрофобный участок. Полагают, что его функция состоит в связывании и узнавании участков других белков, вовлечённых в процесс переноса электрона.
Пластоцианин (Cu 2+ Pc) восстанавливается цитохромом f :
После восстановления Cu + Pc связывается с субъединицей F фотосистемы I. P700 + окисляет Cu + Pc:
Редокс-потенциал пластоцианина — около +0,37 В , а изоэлектрическая точка — при pH около 4 .