Бирнбаум, Роджер
- 1 year ago
- 0
- 0
Муковисцидо́з ( кистозный фиброз ) — системное наследственное аутосомно-рецессивное заболевание, обусловленное мутацией гена трансмембранного регулятора муковисцидоза и характеризующееся поражением желёз внешней секреции , тяжёлыми нарушениями функций органов дыхания . Муковисцидоз представляет особый интерес не только из-за широкой распространённости, но и потому, что это одно из первых наследственных заболеваний, которые пытались лечить. Впервые муковисцидоз был признан отдельной нозологией Дороти Андерсен в 1938 году.

Ген, ответственный за муковисцидоз, был клонирован в 1989 году. Благодаря этому удалось выяснить природу мутации и усовершенствовать метод выявления носителей. В основе заболевания лежат мутации в гене CFTR , который локализован в середине длинного плеча 7-й хромосомы . Муковисцидоз наследуется по аутосомно-рецессивному типу и регистрируется в большинстве стран Европы с частотой 1:2000-1:2500 новорождённых. В России в среднем частота болезни 1:10000 новорождённых. Если оба родителя гетерозиготные (являются носителями мутировавшего гена), то риск рождения больного муковисцидозом ребёнка составляет 25 %. Носители только одного дефектного гена (аллели) не болеют муковисцидозом. По данным исследований, частота гетерозиготного носительства патологического гена равна 2-5 %.
Идентифицировано около 2000 мутаций гена муковисцидоза. Следствием мутации гена является нарушение структуры и функции белка, получившего название муковисцидозного трансмембранного регулятора проводимости ( МВТП ). Следствием этого является сгущение секретов желёз внешней секреции, затруднение эвакуации секрета и изменение его физико-химических свойств, что, в свою очередь, и обусловливает клиническую картину заболевания. Изменения в поджелудочной железе, органах дыхания, желудочно-кишечном тракте регистрируются уже во внутриутробном периоде и с возрастом пациента неуклонно нарастают. Выделение вязкого секрета экзокринными железами приводит к затруднению оттока и застою с последующим расширением выводных протоков желез, атрофией и развитием прогрессирующего фиброза. Активность ферментов кишечника и поджелудочной железы значительно снижена. Наряду с формированием склероза в органах имеет место нарушение функций фибробластов . Установлено, что фибробласты больных муковисцидозом продуцируют , или М-фактор, который обладает антицилиарной активностью — он нарушает работу ресничек эпителия.
В настоящее время рассматривается возможное участие в развитии патологии лёгких при МВ генов, ответственных за формирование иммунного ответа (в частности, генов интерлейкина-4 (IL-4) и его рецептора), а также генов, кодирующих синтез оксида азота (NO) в организме .
Патологические изменения в лёгких характеризуются признаками хронического бронхита с развитием бронхоэктазов и диффузного . В просвете бронхов находится вязкое содержимое слизисто-гнойного характера. Нередкой находкой являются ателектазы и участки эмфиземы . У многих больных течение патологического процесса в лёгких осложняется наслоением бактериальной инфекции (патогенный золотистый стафилококк , гемофильная и синегнойная палочка ) и формированием деструкции.
В поджелудочной железе выявляется диффузный фиброз, утолщение междольковых соединительнотканных прослоек, кистозные изменения мелких и средних протоков. В печени отмечается очаговая или диффузная жировая и белковая дистрофия клеток, желчные стазы в междольковых желчных протоках, лимфогистиоцитарные инфильтраты в междольковых прослойках, фиброзная трансформация и развитие цирроза .
При мекониевой непроходимости выражена атрофия слизистого слоя, просвет слизистых желёз кишечника расширен, заполнен эозинофильными массами секрета, местами имеет место отёк подслизистого слоя, расширение лимфатических щелей. Нередко муковисцидоз сочетается с различными пороками развития желудочно-кишечного тракта.
Различают следующие клинические формы муковисцидоза:
70 % случаев муковисцидоза выявляются в течение первых двух лет жизни ребёнка . С внедрением неонатального скрининга время выявления значительно сократилось.
У 30—40 % больных муковисцидоз диагностирован в первые дни жизни в виде мекониевой непроходимости . Данная форма заболевания обусловлена отсутствием трипсина , что приводит к скоплению в петлях тонкого кишечника (чаще всего в илеоцекальной области ) плотного, вязкого по консистенции мекония.
У здорового новорождённого первородный кал отходит на первые, реже — вторые сутки после рождения. У больного ребёнка отсутствует выделение мекония. Ко второму дню жизни ребёнок становится беспокойным, живот вздут, отмечаются срыгивания и рвота с примесью жёлчи . Через 1—2 дня состояние новорождённого ухудшается: кожные покровы сухие и бледные, на коже живота появляется выраженный сосудистый рисунок, тургор тканей снижен, беспокойство сменяется вялостью и адинамией , нарастают симптомы интоксикации и эксикоза .
При объективном обследовании пациента отмечаются одышка и тахикардия , при перкуссии живота — тимпанит, при аускультации перистальтика не прослушивается. Обзорная рентгенограмма органов брюшной полости позволяет выявить вздутые петли тонкого кишечника и спавшиеся отделы в нижней части живота.
Осложнением мекониевой непроходимости может быть с развитием мекониевого перитонита . Нередко на фоне непроходимости кишечника у больных муковисцидозом на 3—4 сутки жизни присоединяется пневмония , которая принимает затяжной характер. Кишечная непроходимость может развиться и в более позднем возрасте больного.
Симптомами бронхо-лёгочной формы муковисцидоза являются вялость, бледность кожных покровов, недостаточная прибавка массы тела при удовлетворительном аппетите. В некоторых случаях (тяжёлое течение) с первых дней жизни у больного появляется покашливание, которое постепенно усиливается и приобретает коклюшеподобный характер. Кашель сопровождается отделением густой мокроты , которая при наслоении бактериальной флоры становится впоследствии слизисто-гнойной.
Повышенная вязкость бронхиального секрета приводит к развитию мукостаза и закупорке мелких бронхов и бронхиол , что способствует развитию эмфиземы, а при полной закупорке бронхов — формированию ателектазов. У детей раннего возраста в патологический процесс быстро вовлекается паренхима лёгкого, что приводит к развитию тяжёлой, затяжной пневмонии со склонностью к абсцедированию . Поражение лёгких всегда двустороннее.
При объективном обследовании отмечаются влажные мелко- и среднепузырчатые хрипы, а при перкуссии выслушивается коробочный оттенок звука. У больных может развиться токсикоз и даже клиника шока на фоне заболеваний, протекающих с высокой температурой тела, или в жаркое время года при значительной потере натрия и хлора с потом . В дальнейшем пневмония приобретает хроническое течение, формируются пневмосклероз и бронхоэктазы, появляются симптомы « лёгочного сердца », и сердечная недостаточность .

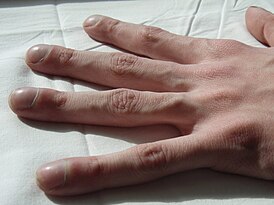
При этом в клинической картине обращает на себя внимание внешний вид больного: бледная кожа с землистым оттенком, акроцианоз, общий цианоз , одышка в покое, бочкообразная форма грудной клетки, деформации грудины по типу «клиновидной» и деформации концевых фаланг пальцев по типу « барабанных палочек », ограничение двигательной активности, язык фиолетового цвета, снижение аппетита и уменьшение массы тела.
Редкими осложнениями при муковисцидозе являются пневмо- и , . При более благоприятном течении муковисцидоза, что наблюдается при манифестации заболевания в более старшем возрасте, бронхолёгочная патология проявляется медленно прогрессирующим деформирующим бронхитом с умеренно выраженным пневмосклерозом.
При длительном течении заболевания в патологический процесс вовлекается носоглотка: синусит , аденоидные вегетации , полипы носа, хронический тонзиллит . Рентгенологическое исследование лёгких при муковисцидозе позволяет выявить распространённые перибронхиальные, инфильтративные, склеротические изменения и ателектазы на фоне выраженной эмфиземы. При бронхографии отмечается наличие каплевидных , отклонений бронхов и уменьшение числа мелких разветвлений, бронхи 3—6-го порядка в виде чёток . При бронхоскопии нередко обнаруживают небольшое количество густой вязкой мокроты, располагающейся в виде нитей в просветах крупных бронхов. Микробиологическое исследование мокроты у больных муковисцидозом позволяет выделить золотистый стафилококк, гемофильную и синегнойную палочки. Наличие синегнойной палочки в мокроте является прогностически неблагоприятным признаком для пациента.
Клиническая симптоматика кишечной формы обусловлена секреторной недостаточностью желудочно-кишечного тракта. Нарушение ферментативной активности желудочно-кишечного тракта особенно ярко выражено после перевода ребёнка на искусственное вскармливание или прикорм и проявляется недостаточным расщеплением и всасыванием белков , жиров и в меньшей степени углеводов . В кишечнике преобладают гнилостные процессы , сопровождающиеся накоплением газов, что приводит к вздутию живота. Дефекации частые, отмечается полифекалия (суточный объём каловых масс в 2—8 раз может превышать возрастную норму). После того, как больного муковисцидозом ребёнка начинают высаживать на горшок, нередко отмечается выпадение прямой кишки (у 10—20 % больных). Больные предъявляют жалобы на сухость во рту, что обусловлено высокой вязкостью слюны . Больные с трудом пережёвывают сухую пищу, а во время еды употребляют значительное количество жидкости. Аппетит в первые месяцы сохранён или даже повышен, но вследствие нарушения процессов пищеварения у больных быстро развивается гипотрофия , . Мышечный тонус и тургор тканей снижен. Больные предъявляют жалобы на боли в животе различного характера: схваткообразные — при метеоризме , мышечные — после приступа кашля , боли в правом подреберье — при наличии , боли в эпигастральной области обусловлены недостаточной нейтрализацией желудочного сока в двенадцатиперстной кишке при сниженной секреции поджелудочной железой .
Нарушение нейтрализации желудочного сока может стать причиной развития язвенной болезни двенадцатиперстной кишки или язвенного процесса в тонком кишечнике. Осложнениями кишечной формы муковисцидоза могут быть вторичная , кишечная непроходимость , вторичный пиелонефрит и мочекаменная болезнь на фоне обменных нарушений, латентно протекающий сахарный диабет при поражении поджелудочной железы. Нарушение приводит к гипопротеинемии , что становится причиной развития в некоторых случаях у детей грудного возраста отёчного синдрома.
Гепатомегалия (увеличение печени) обусловлена холестазом . При в клинической картине можно наблюдать желтуху , кожный зуд , признаки портальной гипертензии , асцит . Цирроз печени у некоторых больных может развиться и без холестаза.
Смешанная форма муковисцидоза является наиболее тяжёлой и включает клинические симптомы как лёгочной, так и кишечной форм. Обычно с первых недель жизни больного отмечаются тяжёлые повторные бронхиты и пневмонии с затяжным течением, постоянный кашель, и резкие . Клиническая картина муковисцидоза отличается значительным полиморфизмом , что и определяет варианты течения заболевания. Отмечена зависимость тяжести течения муковисцидоза от сроков появления первых симптомов — чем младше ребёнок к моменту манифестации болезни, тем тяжелее его течение и более неблагоприятен прогноз. Учитывая полиморфизм клинических проявлений муковисцидоза, тяжесть течения принято оценивать в большинстве случаев характером и степенью поражения бронхолёгочной системы.
Различают 4 стадии патологических изменений бронхолёгочной системы при муковисцидозе:
Диагноз муковисцидоза определяется данными клинических и лабораторных методов обследования пациента. В целях ранней диагностики муковисцидоз входит в программу обследования новорождённых на наследственные и врождённые заболевания. Исследуют уровень в сухом пятне крови. При положительном результате тест повторяют на 21—28 день жизни. При повторном положительном результате назначают .
Для постановки диагноза заболевания необходимо наличие четырёх основных критериев: хронический бронхолёгочный процесс и кишечный синдром, случаи муковисцидоза у сибсов , положительные результаты потового теста. Пот для исследования собирают после электрофореза с пилокарпином . Минимальное количество пота, необходимое для получения достоверного результата, составляет 100 мг. Разница между показателями натрия и хлора в пробе не должна превышать 20 ммоль /л, в противном случае исследование повторяют. При отработанной методике допустимо определение одного из ионов. У здоровых детей концентрация ионов натрия и хлора в поте не должна превышать 40 ммоль/л. Диагностически достоверным критерием муковисцидоза является содержание ионов хлора выше 60 ммоль/л и натрия — выше 70 ммоль/л. Для подтверждения диагноза требуется положительный трёхкратный потовый тест с содержанием хлоридов пота выше 60 ммоль/л. Важное значение в диагностике муковисцидоза имеет копрологическое исследование.
В копрограмме больного муковисцидозом наиболее характерным признаком является повышенное содержание нейтрального жира, но возможно наличие , клетчатки и крахмальных зёрен, что позволяет определить степень нарушения ферментативной активности желёз желудочно-кишечного тракта. Под контролем данных копрологического исследования проводят коррекцию дозы панкреатических ферментов.
Ориентировочными методами для диагностики муковисцидоза являются определение протеолитической активности кала рентгенологическим тестом, активности ферментов поджелудочной железы в дуоденальном содержимом, концентрации натрия в ногтях и секрете слюнных желёз . В качестве скрининг-теста в периоде новорождённости используют метод определения повышенного содержания альбумина в меконии — мекониальный тест (в норме содержание альбумина не превышает 20 мг на 1 г сухой массы).
Особое место в диагностике занимает . В настоящее время в России по наличию известных мутаций в гене CFTR доступны идентификации 65—75 % больных муковисцидозом, что не даёт возможности использовать для верификации диагноза заболевания только молекулярно-генетическое обследование.
Химотрипсин в стуле: проба не стандартизована — нормативные значения разрабатываются в конкретной лаборатории.
Определение жирных кислот в стуле: в норме менее 20 ммоль/день. Пограничные значения — 20—25 ммоль/день. Проба положительна при снижении функции поджелудочной железы не менее чем на 75 %.
ДНК-диагностика наиболее чувствительная и специфическая. Ложные результаты при этом получают в 0,5—3 % случаев. В России её проведение относительно дорого.
Пренатальная диагностика: исследование изоэнзимов тонкокишечной щелочной фосфатазы из околоплодных вод, возможно с 18—20 недели беременности. Ложноположительные и ложноотрицательные значения получают в 4 % случаев.
Дифференциальную диагностику муковисцидоза проводят с коклюшем , , бронхиальной астмой , врождёнными и приобретёнными бронхоэктазами , фиброзом лёгких непанкреатического происхождения. По наличию в поте высоких показателей электролитов муковисцидоз дифференцируют с такими заболеваниями, как несахарный почечный диабет , недостаточность коры надпочечников , наследственная эктодермальная дисплазия , гликогенная болезнь , дефицит глюкозо-h-фосфатазы, , гипотрофия, гаргоилизм , фукозидоз , дегидратация , отёки.
Патогенетическая терапия. В России зарегистрирован в 2020 году комбинированный патогенетический препарат « Оркамби ». Незарегистрированный препарат «Трикафта» (тройная комбинация малых молекул) включён в список закупок фонда «Круг добра».
— препарат предположительно стабилизирующий открытое состояние хлорных каналов, используется для терапии пациентов с определенными мутациями в гене CFTR (E56K, G178R, S549R, K1060T, G1244E, P67L, E193K, G551D, A1067T, S1251N, R74W, L206W, G551S, G1069R, S1255P, D110E, R347H, D579G, R1070Q, D1270N, D110H, R352Q, S945L, R1070W, G1349D, R117C, A455E, S977F, F1074L, R117H, S549N, F1052V, D1152H), которые составляют 4-5 % случаев муковисцидоза. Одобрен FDA в 2012 г. В России не регистрировался. При дефиците в тонком кишечнике из рациона исключают соответствующие сахара (чаще всего лактозу ). Пищу больным всегда подсаливают, особенно в жаркое время года и при высокой температуре, что необходимо, учитывая большие потери солей с потом. Больному обеспечивают потребление достаточного количества жидкости. В питание должны быть включены содержащие витамины продукты, фруктовые и овощные соки, сливочное масло .
В обязательном порядке осуществляют коррекцию нарушенной функции поджелудочной железы путём применения препаратов, содержащих панкреатин . Дозу ферментных препаратов подбирают индивидуально, ориентируясь на данные копрологического исследования.
Показателями оптимального подбора дозы служат нормализация стула и исчезновение в кале нейтрального жира. Начальная доза препарата составляет 2—3 г в сутки. Дозу постепенно повышают до появления положительного эффекта. Для разжижения секретов желудочно-кишечного тракта и улучшения их оттока применяют ацетилцистеин в таблетках и гранулах, что показано при холестазе, вязком дуоденальном содержимом, невозможности провести зондирование. Лечение лёгочного синдрома включает комплекс мероприятий, направленных на разжижение мокроты и удаление её из бронхов. С этой целью применяют физические, химические и инструментальные методы. Муколитическая терапия проводится ежедневно в течение всей жизни пациента. Эффективность лечения повышается при параллельном использовании аэрозольных ингаляций , ЛФК , , постурального дренажа. Количество и длительность ингаляций определяются тяжестью состояния больного. В качестве муколитических препаратов используют соляно-щелочные смеси (3—7 % солевой раствор — хлорид и карбонат натрия), бронхолитические препараты , ацетилцистеин (на одну ингаляцию 2—3 мл 7—10-процентного раствора), пульмозим ( дорназа альфа ). проводится каждое утро, вибрационный массаж — не менее 3 раз в сутки.
Лечебная бронхоскопия с промыванием бронхов ацетилцистеином и изотоническим раствором хлорида натрия показана как экстренная процедура при отсутствии эффекта вышеописанной терапии. В периоды обострения заболевания, при наличии острой пневмонии или острой респираторной вирусной инфекции показано применение антибактериальной терапии.
Антибактериальные средства вводят парентерально (полусинтетические пенициллины , цефалоспорины второго и третьего поколения, аминогликозиды , хинолоны) и в виде аэрозолей ( аминогликозиды : гентамицин , тобрамицин ). Учитывая склонность пневмоний при муковисцидозе к затяжному течению, курс антибиотиков составляет не менее одного месяца, а иногда и больше.
При тяжёлом течении пневмонии применяют кортикостероидные препараты в течение 1,5—2 месяцев. Преднизолон назначают из расчета 1,0—1,5 мг/кг в сутки в течение 10— 15 дней. Затем дозу постепенно снижают.
Антибиотики применяют в течение всего курса кортикостероидной терапии. Наряду с антибактериальной и муколитической терапией проводят полный комплекс лечебных мероприятий, направленных на борьбу с гипоксией , сердечно-сосудистыми нарушениями, изменениями кислотно-основного состояния. При организации диспансерного наблюдения за больными муковисцидозом в амбулаторных условиях необходимо осуществлять контроль за стулом и массой тела больного, регулярно (1 раз в 3 месяца) проводить копрологическое исследование с целью коррекции дозы препаратов поджелудочной железы, весной и при обострении процесса назначать курсы витаминотерапии (оправдано назначение двойной дозы жирорастворимых витаминов А , Е , D в виде водных растворов).
Родственников больного необходимо обучить приёмам постурального дренажа, вибрационного массажа и уходу за пациентом. Наряду с занятиями лечебной физкультурой необходимы физические нагрузки и занятия спортом. При устойчивой ремиссии в течение 6 месяцев разрешается проведение профилактических прививок.
В комплексной терапии муковисцидоза также используется приборная терапия. Для удаления мокроты используются откашливатели, имитирующие естественный кашель чередованием положительного и отрицательного давления в дыхательных путях пациента, а также аппараты перкуссионной вентиляции легких. Для борьбы с гипоксией осуществляют кислородную терапию с использованием домашних кислородных концентраторов. Важное значение имеет питание больного. Суточный калораж должен на 10—30 % превышать возрастную норму за счёт увеличения в рационе белкового компонента. Потребность в белке удовлетворяют употреблением в пищу мяса , рыбы, яиц, творога . Потребление жиров значительно ограничивают. Можно использовать жиры, в состав которых входят жирные кислоты со средним размером цепи, так как их усвоение не зависит от активности липазы поджелудочной железы.
Вариантом лечения хронической лёгочной недостаточности при муковисцидозе является трансплантация лёгких. Теоретическим обоснованием данной методики является отсутствие дефектного гена в клетках донорской ткани. Практически имеет смысл только одномоментная пересадка лёгких донора, а не частичная замена долей либо одного лёгкого пациента донорским. Муковисцидоз является системным заболеванием, при котором в ряде случаев происходит одномоментное симметричное двустороннее поражение ткани лёгких. Кроме того, после успешно выполненной пересадки только одного лёгкого инфекционные процессы оставшегося (второго лёгкого пациента) способны распространяться на донорское, с последующим его повреждением и развитием рецидива дыхательной недостаточности. Также следует отметить, что трансплантация лёгких реципиенту, страдающему от клинических проявлений муковисцидоза, способна существенно улучшить его качество жизни лишь в случае, когда поражение других органов и систем ещё не достигло стадии необратимых изменений. В противном случае клинический эффект оперативного вмешательства будет ограничен коррекцией лишь одного из проявлений системного заболевания. Следует помнить, что успешная пересадка донорских лёгких устраняет лишь лёгочные проявления заболевания и не способна излечить муковисцидоз: лечение основной патологии необходимо продолжать пожизненно .
Первая пересадка лёгких взрослой пациентке с хронической лёгочной недостаточностью, развившейся на фоне муковисцидоза, в России осуществлена в 2012 году. Лёгкие получила жительница Тульской области, которой в Москве выполнено оперативное вмешательство врачами НИИ скорой помощи имени Н. В. Склифосовского и НИИ пульмонологии .
В октябре 2016 года на пресс-конференции, собранной в Федеральном научном центре трансплантологии и искусственных органов им. В. И. Шумакова, официально сообщено об успешном оперативном вмешательстве пациентке 13-ти лет, которое было выполнено месяцем ранее:
«Хочу поздравить коллектив института с первой в нашей стране трансплантацией лёгких ребёнку. Всего в мире таких операций около 10…»
— Вероника Скворцова, министр здравоохранения РФ

Считается, что МВ появился около 3000 лет до н. э. в результате миграции народов, генных мутаций и новых условий питания . Хотя весь клинический спектр муковисцидоза не был известен до 1930-х годов, некоторые аспекты болезни были выявлены гораздо раньше. Немецкие авторы 18 века предупреждали "Wehe dem Kind, das beim Kuß auf die Stirn salzig schmeckt, es ist verhext und muss bald sterben" («Горе ребенку, который на вкус соленый от поцелуя в лоб, ибо он проклят и скоро должен умереть»), что указывало на потерю соли при муковисцидозе .
В 1938 году Дороти Хансин Андерсен ( на илл. ) опубликовала статью «Кистозный фиброз поджелудочной железы и его связь с глютеновой болезнью: клиническое и патологическое исследование» в Американском журнале детских болезней . Она была первой, кто описал характерный кистозный фиброз поджелудочной железы и связал его с заболеванием легких и кишечника, характерным для муковисцидоза . Она также впервые выдвинула гипотезу о том, что муковисцидоз является рецессивным заболеванием, и впервые применила замену ферментов поджелудочной железы для лечения больных детей. В 1952 году Поль ди Сант-Аньезе обнаружил отклонения в электролитах пота .
Впервые связь между муковисцидозом и другим маркером (пароксоназой) была обнаружено в 1985 г. Гансом Эйбергом. В 1988 году Фрэнсис Коллинз , Сюй Личжи и Джон Р. Риордан обнаружили первую мутацию CF, ΔF508 , на седьмой хромосоме. Последующие исследования выявили более 1000 различных мутаций, вызывающих муковисцидоз .
Поскольку мутации в гене CFTR , как правило, невелики, классические методы генетики не могли точно определить мутировавший ген . Используя белковые маркеры, исследования сцепления генов позволили сопоставить мутацию с хромосомой 7 . В 1989 году Сюй Личжи возглавил группу исследователей в больнице для больных детей в Торонто , которые обнаружили ген, ответственный за муковисцидоз .
Прогноз при муковисцидозе до настоящего времени остаётся неблагоприятным. Летальность составляет 50—60 %, среди детей раннего возраста — выше. При поздней диагностике и неадекватной терапии прогноз значительно менее благоприятный. Большое значение приобретает медико-генетическое консультирование семей, в которых есть больные муковисцидозом.
Критерием качества диагностики и лечения муковисцидоза является средняя продолжительность жизни больных. В европейских странах этот показатель достигает 40 лет, в Канаде и США — 48 лет, а в России — 22—30 лет .
На каждого выявленного больного обычно приходится 100 невыявленных .
Муковисцидозом болеют:
{{
cite journal
}}
:
Недопустимый
|display-authors=6
(
справка
)
{{
cite journal
}}
:
Недопустимый
|display-authors=6
(
справка
)