Interested Article - Теория радикалов

- 2021-07-21
- 1
|
|
Эту статью необходимо
исправить в соответствии с
правилом Википедии об оформлении статей
.
|
Теория радикалов — одна из ведущих химических теорий первой половины XIX века. В её основе лежат представления А. Л. Лавуазье об исключительно важном значении кислорода в химии и о дуалистическом (двойственном) составе химических соединений.
Другие определения:
Радикал — группа атомов, содержащая углеводородный остаток в молекуле.
Радикал — по представлениям Лавуазье, группа атомов , переходящих без изменения из одного соединения в другое.
Свободные радикалы — атомы или группы связанных между собой атомов, характеризующиеся наличием неспаренных электронов .
В 1789 году Лавуазье, воспользовавшись термином «радикал», высказал мнение, что неорганические кислоты — это соединения кислорода с простыми радикалами (состоящими из одного элемента ), а органические кислоты — это соединения кислорода со сложными радикалами (состоящими из углерода и водорода ). Открытие циана ( Ж. Л. Гей-Люссак , 1815) и аналогия между цианидами KCN, AgCN, Hg(CN) 2 и хлоридами КСl, AgCl, HgCl 2 укрепили понятие о сложных радикалах, как о группах атомов, переходящих без изменения из одного соединения в другое. Такой взгляд получил авторитетную поддержку И. Берцелиуса (1819). В 1827 году французские химики Ж. Дюма и П. Булле предложили рассматривать винный спирт и эфир как гидраты «этерина» ( этилена ) С 2 Н 4 .Н 2 О и 2С 2 Н 4 . Н 2 О. В 1832 году Ю. Либих и Ф. Вёлер показали, что атомная группа бензоил C 7 H 5 O образует соединения C 7 H 5 OH ( бензойный альдегид ), С 7 Н 5 ОСl (хлористый бензоил), (C 7 H 5 O) 2 О (бензойный ангидрид). В 1834 году Ж. Дюма и французский химик Э. М. Пелиго ввели название « метил » для СН 3 ( хлористый метил СН 3 Сl, метиловый спирт СН 3 ОН), а Ю. Либих — « этил » для С 2 Н 5 ( хлористый этил С 2 Н 5 Сl, этиловый спирт С 2 Н 5 ОН). Либих и Дюма считали (1837), что органическая химия — это химия сложных радикалов, а неорганическая — химия простых радикалов. В 1840—1850 годах радикальная теория под напором противоречащих ей фактов была вытеснена теорией типов . Тем не менее теория радикалов сыграла прогрессивную роль как средство классификации органических соединений и как одна из предпосылок к созданию теории химического строения .
История
Основанием для создания теории радикалов послужили исследования соединений циана (Гей-Люссак, 1815). Этими исследованиями было впервые установлено, что при целом ряде химических превращений группа из нескольких атомов переходит, не изменяясь, из молекулы одного вещества в молекулу другого, подобно тому, как переходят из молекулы в молекулу атомы элементов. Таким образом, группа атомов, называемая радикалом, играет как бы роль одного атома, отличаясь от последнего только сложностью.
Так, например, радикал циан CN в химических реакциях обнаруживает большое сходство с галоидами . В синильной кислоте HCN атом водорода соединен с радикалом цианом ( цианистый водород ) так же; как в соляной кислоте НCl он соединен с атомом хлора ( хлористый водород ). Целый ряд сходных солей HCN и НCl может быть получен реакциями обменного разложения : КCl и KCN; AgCl и AgCN; HgCl 2 и Hg(CN) 2 .
Были найдены и другие реакции, в которых радикал «циан» переходит из одного вещества в другое без изменения:
- KCN + Cl 2 → КCl + (CN)Cl ( хлористый циан )
- KCN + Вr 2 → КВr + (CN)Вr (бромистый циан)
Эти реакции совершенно аналогичны соответствующим реакциям галоидных соединений, например:
- KJ + Cl 2 → КCl + JCl (хлористый иод)
Наконец, подобно галоидам , циан может быть получен в свободном виде:
- Hg(CN) 2 → Hg + (CN) 2
Сильное влияние на признание теории радикалов оказали осуществленные позднее (1832) Либихом и Вёлером исследования «горькоминдального масла» — вещества состава С 7 Н 6 О, которое теперь называется бензойным альдегидом . При изучении реакций этого вещества они получили ряд соединений, неизменно содержавших в молекуле группу атомов С 7 Н 5 О, названную, ими радикалом «бензоилом»:
- С 7 Н 5 О—Н — водородистый бензоил (бензойный альдегид)
- С 7 Н 5 О—Cl — хлористый бензоил
- С 7 Н 5 О—ОН — гидроокись (бензойная кислота)
- С 7 Н 5 О—ONa — бензоат натрия и т. д.
Результаты этих исследований были восприняты как доказательство того, что органические вещества состоят из радикалов, точно так же, как неорганические — из атомов. Казалось, что природа органического вещества раскрыта — органическая химия является «химией сложных радикалов» и в её развитии начинается новая эра. Предлагалось даже переименовать «бензоил» в «проин» (греч. — начало дня) или в «ортрин» (греч.— утренний рассвет).
С этого времени начинаются усиленные поиски новых радикалов и изучение многочисленных реакций, которые ведут к получению различных соединений этих радикалов.
Значение этих исследований состоит также в том, что на их основе была пересмотрена роль кислорода в химии. С конца XVIII века, после крушения теории флогистона , кислороду отводилось исключительное место в химии. Этот элемент характеризовали тем, что, соединяясь с металлами , он дает основания , а с неметаллами — кислоты ; его рассматривали вообще как элемент, сообщающий некоторые отличительные свойства тем соединениям, в состав которых он входит. Представления об исключительной роли кислорода в неорганической химии были перенесены в область органической химии: так, например, считалось, что многие органические вещества следует рассматривать как окислы некоторых органических радикалов. В связи с этим открытие, что такой органический радикал, как бензоил, уже содержит кислород, превращало последний из главного в обыкновенный химический элемент, по крайней мере в органической химии.
В сравнительно короткий срок были открыты соединения радикалов метила СН 3 , этила С 2 Н 5 , ацетила С 2 Н 3 О и др. Для метила, например, были получены следующие соединения: CH 3 Cl, CH 3 Br, CH 3 J (хлористый, бромистый и йодистый метил), (СН 3 ) 2 О (окись метила, или диметиловый эфир), СН 3 ОН (гидроокись метила, или метиловый спирт), CH 3 HSO 4 (кислый сернокислый метил, или метилсерная кислота) и др.
В конце 30-х годов XIX века Р. Бунзен в своих классических исследованиях какодиловых соединений показал, что они содержат радикал AsC 2 H 6 , обладающий свойствами металла. По Бунзену, этот радикал играет роль простого электроположительного элемента, являясь подлинным органическим элементом. Бунзен считал, что при действии металлов на хлористый какодил получается радикал какодил в свободном состоянии (на самом деле — дикакодил, C 4 H 12 As 2 ).
На определённом этапе развития органической химии теория радикалов оказала ей серьезные услуги, впервые дав химикам руководящую нить в исследовании органического вещества. Это оказалось возможным потому, что в основе теории радикалов лежало важное обобщение: при химических реакциях группы атомов часто в неизменном виде переходят из исходных молекул в молекулы, образующиеся при этих реакциях.
Основная идея теории радикалов, сводившаяся к тому, что органические вещества составлены из радикалов, как неорганические— из атомов, в большой мере стимулировали исследование органических веществ в определённый период развития органической химии . Однако вместе с тем теория радикалов имела ряд принципиальных недостатков, которые она не смогла преодолеть. Главными причинами отказа от этой теории были следующие:
1. Теория радикалов совершенно не ставила вопроса о том, как построены сами радикалы, и вследствие такой односторонности не могла стать главной движущей силой развития науки на длительный период.
2. Попытки объяснить связь между радикалами с позиций электрохимической теории привели к распространению на теорию радикалов недостатков взглядов Берцелиуса . Эти недостатки сказывались здесь ещё в большей степени, чем в неорганической химии, в силу специфики органических веществ. Частным проявлением механического копирования представлений неорганической химии было то, что, по аналогии с атомами, допускалась возможность существования радикалов в свободном виде. Считалось, что радикалы почти так же прочны, как атомы, и могут изменяться только в очень жестких условиях.
Не умея определять молекулярные веса , химики считали, что газообразные простые неорганические вещества, например водород , кислород , хлор и т. д., имеют формулы Н, О, Cl, а не Н 2 , О 2 , Cl 2 . По той же причине считали, что при нагревании цианистой ртути образуется свободный радикал CN, а при реакциях йодистого метила и йодистого этила с натрием — свободные радикалы метил и этил. После того как было доказано, что указанные соединения не являются свободными радикалами, а имеют удвоенный молекулярный вес, отвечающий молекулам (CN) 2 , (CH 3 ) 2 , (С 2 Н 5 ) 2 ит. д., теория радикалов в значительной мере уже была поколеблена.
Однако решающим ударом для теории радикалов явилось открытие французским химиком Дюма химических реакций, при которых необыкновенно легко изменялись некоторые из наиболее обычных радикалов. Исследуя действие
хлора
на органические вещества, Дюма открыл, что атомы хлора могут замещать в их молекулах атомы водорода («реакция металепсии»). Особенно поразительными казались реакции замещения водорода на хлор в молекуле уксусной кислоты, формулу которой, по Берцелиусу, следовало изображать таким образом: С
2
Н
3
ООН.
При действии хлора на
уксусную кислоту
легко происходило замещение атома водорода на атом хлора в радикале ацетила
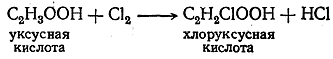 ,
причем полученное вещество по своим химическим свойствам мало отличалось от самой уксусной кислоты.
При действии хлора на хлоруксусную кислоту легко происходило дальнейшее замещение сначала второго, а затем и третьего атома водорода на атом хлора:
,
причем полученное вещество по своим химическим свойствам мало отличалось от самой уксусной кислоты.
При действии хлора на хлоруксусную кислоту легко происходило дальнейшее замещение сначала второго, а затем и третьего атома водорода на атом хлора:
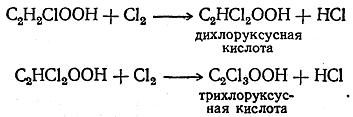 .
Соединения, получающиеся в результате этих реакций, по своим химическим свойствам также мало отличаются как от хлоруксусной, так и от уксусной кислоты. Таким образом, не только легко изменялся сам радикал, но, кроме того, замена электроположительного водорода на электроотрицательный хлор мало влияла на химические свойства соединения.
.
Соединения, получающиеся в результате этих реакций, по своим химическим свойствам также мало отличаются как от хлоруксусной, так и от уксусной кислоты. Таким образом, не только легко изменялся сам радикал, но, кроме того, замена электроположительного водорода на электроотрицательный хлор мало влияла на химические свойства соединения.
Между тем, согласно Берцелиусу, при реакциях замещения электроположительные атомы заменяются лишь другими электроположительными, а электроотрицательные — электроотрицательными атомами. Попытки заменить электроположительный атом в молекуле на электроотрицательный (или наоборот) должны, как правило, приводить к разрушению молекулы. Если бы в виде исключения такая попытка и удалась, она привела бы к столь глубоким изменениям в молекуле, что полученное новое вещество самым резким образом отличалось бы от исходного.
Открытия Дюма казались сторонникам теории радикалов совершенно невероятными, и Берцелиус и его ученики обрушились на Дюма с почти небывалой в науке резкостью, отрицая правильность его исследования. Однако прав оказался Дюма, и теория радикалов была отвергнута. На смену ей пришла теория замещения, а затем — теория типов .
См. также
Примечания
Литература
- Чичибабин А. Е. ,. Основные начала органической химии / Под ред. проф. П. Г. Сергеева. — 6-е, стереотип.. — М. : Госхимиздат, 1954. — Т. 1. — С. 40—44. — 796 с.
- Копытов, Владимир Вячеславович, and Олег Михайлович Лепешкин. «Метод разрешения конфликтов доступа в информационно-управляющих системах на основе среды радикалов.» Наука. Инновации. Технологии 75 (2011).
- Воробьев Н. Т. О некоторых проблемах теории радикалов и радикальных классов конечных групп. — 2012.
Ссылки
- 2021-07-21
- 1