Interested Article - Синдром Вискотта — Олдрича

- 2020-05-28
- 1
Синдром Вискотта — Олдрича ( СВО , англ. Wiskott–Aldrich syndrome — WAS ) — редкое Х-сцепленное рецессивное заболевание, характеризующееся наличием экземы , тромбоцитопении (с уменьшением количества и размеров тромбоцитов), иммунодефицита , и кровавого поноса (обусловленного тромбоцитопенией). Синоним — синдром экземы-тромбоцитопении-иммунодефицита в соответствии с оригинальным описанием Олдрича ( англ. Aldrich ), сделанным в 1954 году.
История
В 1937 году немецкий педиатр Вискотт ( нем. Alfred Wiskott ) описал трёх братьев с низким количеством тромбоцитов (тромбоцитопенией), кровавым поносом, экземой и рецидивирующими инфекциями уха, в то время как их четыре сестры были здоровы. Вискотт охарактеризовал её как болезнь Верльгофа .
В 1954 году американский педиатр Олдрич ( англ. Robert Anderson Aldrich ) на семье американцев голландского происхождения показал, что этот синдром наследуется как Х-сцепленный рецессивный признак .
Эпидемиология
Сочетание синдрома Вискотта — Олдрича с Х-сцепленной тромбоцитопенией встречается у 4—10 из 1 млн родившихся живыми. Географический фактор не имеет значения.
Болеют почти исключительно лица мужского пола. Случаи заболевания лиц женского пола, хоть и описаны в литературе, но очень редки и связаны с подавлением активности одной из X-хромосом .
Женщины в подавляющем большинстве случаев выступают лишь в роли гетерозиготных носителей и сами почти никогда не болеют, однако для женщин с врождённой тромбоцитопенией оценка гена WASP может оказаться важным диагностическим исследованием .
Этиология
Ген WAS, мутации в котором приводят к развитию данного заболевания, локализован на коротком плече Х-хромосомы . Возникновение мутации в гене, ответственном за синтез белка WASp, приводит к появлению дефектной формы белка или к полному его отсутствию, что влечёт за собой развитие нарушений иммунитета и гемостаза.
Известно более 350 мутаций в гене WAS, которые приводят к иммунодефициту и тромбоцитопении .
Тип мутации гена WAS существенно коррелирует со степенью тяжести заболевания: те, которые привели к производству усечённого белка, сопровождаются значительно более тяжёлыми симптомами, чем те, которые кодируют нормальную длину белка WASp. Аутоиммунные заболевания и злокачественные новообразования могут произойти при обоих типах мутаций, но пациенты с усечённым геном WAS подвергаются повышенному риску .
Наследование
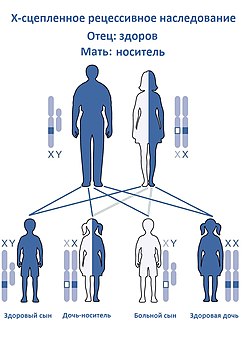
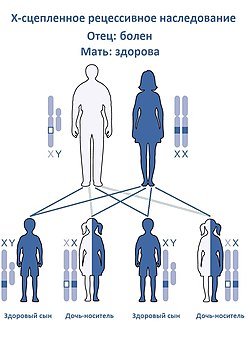
Как любое другое Х-сцепленное рецессивное заболевание, Синдром Вискотта — Олдрича наследуется следующим образом.
Женщина-носитель при каждой беременности имеют 25%-ю вероятность родить здоровую дочь-носителя (как она сама), 25%-ю вероятность родить здоровую дочь без носительства мутантного гена, 25%-ную вероятность родить больного сына и 25%-ю вероятность родить здорового сына. Это также означает, что каждая дочь имеет 50 % шанс стать носителем, а каждый сын имеет 50 % вероятность наличия заболевания .
Примерно у 1/3 пациентов с вновь диагностированным СВО причиной заболевания является новая мутация, произошедшая во время оплодотворения яйцеклетки , то есть не унаследована от матери .
|
|
Патогенез
При WAS снижается количество или вовсе не продуцируется белок WAS (WAS-protein, WASP). Уникальные функции WASP до конца ещё не изучены, однако установлено, что он играет ключевую роль в полимеризации белка актина и формировании цитоскелета. В последнем процессе (в формировании цитоскелета — микрофибрилл, филоподий, фагоцитарных вакуолей и т. д.) принимает непосредственное участие белок миозин , концентрация которого значительно снижена в тромбоцитах больных с WAS. WASP экспрессируется только в клетках гемопоэтической системы. WASP имеет исключительное значение для передачи сигнала от поверхностных рецепторов клетки к цитоскелету, что динамически регулируется им. Это приводит к дефектам формирования всех клеточных структур, образование которых зависит от цитоскелетной реорганизации актиновых филаментов и в результате нарушения многих функций клеток, что в норме экспрессируют WASP, а именно лейкоцитов и тромбоцитов.
Полноценная функция актинового цитоскелета крайне важна уже на стадии продукции тромбоцитов мегакариоцитами в костном мозге , а также для реализации их адгезивных, агрегационных и других функций. Тромбоцитопения и уменьшения размера тромбоцитов (диаметром менее 1,5 мкм при норме 2,3 мкм) является постоянным симптомом при данной патологии.
Основными причинами этого являются
- повышенное разрушение клеток;
- нарушенный метаболизм ;
- неэффективен тромбоцитопоэз .
Число тромбоцитов колеблется от 30×10 9 /л до 140×10 9 /л, но периодически снижается до 10—30×10 9 /л. В пунктате костного мозга определяют отсутствие мегакариоцитов или наличие их дегенеративных форм. В большинстве случаев геморрагический синдром усиливается на фоне инфекций. У больного может также развиться хроническая постгеморрагическая анемия и увеличение селезёнки ( спленомегалия ).
Иммунная система пациентов с WAS производит очень мало B- и T- лимфоцитов, которые необходимы для защиты организма от инфицирования. Существенно нарушается хемотаксис WASP-дефицитных лейкоцитов, снижается пролиферативный ответ лимфоцитов, нарушается формирование иммунных синапсов Т-лимфоцитов, значительно ослабляется цитолитическая активность натуральных киллеров , также ухудшается IgG-опосредованный фагоцитоз и соответственно, нарушается презентация антигенов. По этой причине пациенты с WAS страдают повторными бактериальными, грибковыми и вирусными инфекциями.
Клиническая картина
Синдром Вискотта — Олдрича поражает мальчиков и проявляется следующими симптомами: атопическим дерматитом , геморрагическим синдромом ( снижением количества тромбоцитов , гемоглобина, эритроцитов) и комбинированным дефицитом В- и Т-лимфоцитов , который ведёт к повторяющимся инфекционным процессам (частые ОРЗ , бронхолёгочные инфекции, инфекции ЛОР-органов, кожи, слизистых, мочевыводящих путей и ЖКТ). Поскольку число тромбоцитов снижено, первым симптомом может быть кровоточивость, например кровавая диарея. Изменение уровня сывороточных иммуноглобулинов — низкий IgM, высокий IgA, очень высокий IgE, уровень IgG может быть нормальным, пониженным или повышенным . Дефицит В- и Т- лимфоцитов делает детей восприимчивыми к заболеваниям, вызванным бактериями, вирусами и грибами. Распространены инфекционные поражения дыхательных путей. У детей, доживших до 10-летнего возраста, развивается по крайней мере одно аутоиммунное заболевание ; до трети пациентов страдают онкологическими заболеваниями , в основном это лимфомы и лейкозы .
Патофизиология
В 1994 году синдром Вискотта — Олдрича был связан с мутациями в гене на коротком плече X-хромосомы , продукт этого гена был назван англ. Wiskott–Aldrich syndrome protein ( белок синдрома Вискотта — Олдрича ). Позже было открыто, что Х-сцепленная тромбоцитопения объясняется мутацией гена WAS. Кроме того, редкое заболевание — Х-сцепленная нейтропения — связана с особой мутацией гена WAS.
WASp кодируется геном WAS, который содержит 502 аминокислотных остатка ; в основном выражен в клетках гемопоэза (эти клетки вырабатываются красным костным мозгом и затем развиваются в клетки крови). Точная функция белка WASp ещё не известна, но были предложены сигнальная трансдукция и поддержание цитоскелета (при СВО нарушен синтеза белка, необходимого для полимеризации актина в клетках и формирования цитоскелета).
Иммунодефицит обусловлен снижением выработки антител, также повреждаются Т-лимфоциты (то есть иммунодефицит является комбинированным). Это ведёт к повышенной восприимчивости к инфекционным заболеваниям, в особенности глаз и ЛОР-органов.
Существует более лёгкая форма СВО, названная Х-сцепленная тромбоцитопения (X-linked trombocytopenia — XLT). При обследовании мальчиков с этим заболеванием, не имеющих других признаков СВО, были выявлены более 60 мутаций в гене WAS, аналогичные таковым при классическом синдроме Вискотта — Олдрича. По неизвестным причинам XLT отличается более мягким течением без выраженных признаков иммунодефицита .
Лечение
Радикальное
Поскольку у больных синдромом Вискотта — Олдрича снижено количество тромбоцитов, а тромбоциты разрушаются в селезёнке, спленэктомия часто помогает уменьшить проявления геморрагического синдрома, но не излечивает другие нарушения, характерные для СВО.
Эффективна трансплантация костного мозга , однако трансплантация осложняется трудностью в выборе донора, возможной гипофункцией трансплантата, риском отторжения (реакция «трансплантат против хозяина») и частыми посттрансплантационными осложнениями в виде вирусной, бактериальной и грибковой инфекции.
Консервативное
Экзему сдерживают при помощи местных или системных стероидов, а также общим тщательным уходом за кожей .
При массивных кровотечениях показано переливание крови (пациентам с глубоким падением Т-клеточного иммунитета показаны только облучённые Ле-фильтрованные препараты крови).
Возможно проведение заместительной терапии эритроцитарной массой и тромбоконцентратом .
Для лечения, а часто и для профилактики заболеваний бактериальной этиологии применяют Антибиотики ( цефалоспорины , аминогликозиды , полусинтетические пенициллины , сульфаниламиды ).
Многим пациентам в профилактических целях показан длительный приём противогрибковых препаратов.
Для увеличения количества тромбоцитов применяют агонисты тромбопоэтиновых рецепторов : ромиплостим и .
Целесообразно переливание внутривенных иммуноглобулинов.
Генотерапия
Начаты исследования коррекции синдрома Вискотта — Олдрича методом генотерапии , используя лентивирус . Доказана принципиальная возможность успешной генотерапии гемопоэтических стволовых клеток у пациентов с синдромом Вискотта — Олдрича . В настоящее время исследователи продолжают развивать оптимизированные векторы генотерапии . В июле 2013 итальянский San Raffaele Telethon Institute for Gene Therapy (HSR-TIGET) сообщил, что на трёх детях с синдромом Вискотта — Олдрича показано существенное улучшение спустя 20-30 месяцев после применения генетически модифицированного лентивируса . Последние испытания генной терапии продемонстрировали обнадёживающие результаты для пациентов, которым невозможно подобрать подходящего донора стволовых клеток (костного мозга) .
Эта стратегия может как обеспечить клиническую пользу, так и привести к расширению и злокачественной трансформации гемопоэтических клонов с переносными векторными вставками вблизи онкогенов, что увеличит риск лейкеми .
Прогноз
Прогноз очень зависит от того, какая именно мутация в гене WAS вызвала заболевание . В общем случае без применения трансплантации костного мозга прогноз неблагоприятный. С применением трансплантации — обнадёживающий.
В связи с тем, что антибиотикотерапия , переливание компонентов крови и трансплантация стволовых клеток костного мозга стали более доступны, медиана выживаемости увеличилась с 8 месяцев у пациентов, родившихся до 1935 года, до 6 лет у пациентов, родившихся после 1964 года. По современным данным медиана продолжительности жизни составляет от 8 до 11 лет. В случае, если не применялась трансплантация стволовых клеток костного мозга, молодые пациенты имеют больше шансов умереть от кровотечения, дети чаще умирают от инфекций, а дети и подростки чаще всего умирают от злокачественных новообразований. Лимфомы встречаются у 26 % больных в возрасте от 20 лет и старше. Общий риск злокачественных онкологических заболеваний более чем в 100 раз превышает средний по популяции, а с возрастом увеличивается ещё сильнее .
Трансплантация стволовых клеток костного мозга, если удалось преодолеть реакцию «трансплантат против хозяина», приводит к нормализации показателей крови и делает прогноз благоприятным. Выживаемость после применения стволовых клеток продолжает улучшаться.
Прогноз тем благоприятнее, чем меньше времени прошло между установлением диагноза и трансплантацией гемопоэтических стволовых клеток, если её выполнять в возрасте пациента до 5-6 лет и до возникновения значительных осложнений.
Несмотря на то, что СВО остаётся тяжёлым заболеванием, при котором возможны угрожающие жизни осложнения, многие больные мужского пола доживают до подросткового или даже взрослого возраста, ведут продуктивную жизнь и имеют собственные семьи. Самым старшим из больных, получивших трансплантацию костного мозга, сейчас больше тридцати лет, и они кажутся выздоровевшими без развития злокачественных опухолей или аутоиммунных заболеваний .
Режим
В связи с высокой возможностью заражения на время обострения необходимо помещать больных с синдромом Вискотта — Олдрича в бокс . По тем же причинам больным с синдромом Вискотта — Олдрича противопоказано нахождение в детском коллективе. Также противопоказаны прививки живыми вакцинами (существует вероятность того, что вакцинный штамм вируса может вызвать заболевание) и препаратами, содержащими полисахаридные антигены (непонятно, выработаются ли нужные антитела).
См. также
Примечания
- (англ.) — 2016.
- Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- Wiskott A. Familiarer angeborener Morbus Werlhofii. Monastsschr // Monastsschr. Kinderleil. Kd. — 1937. — Vol. 68. — P. 212—216.
- Aldrich R. A. , Steinberg A. G. , Campbell D. C. (англ.) // Pediatrics. — 1954. — Vol. 13, no. 2 . — P. 133—139. — .
- Wengler G. , Gorlin J. B. , Williamson J. M. , Rosen F. S. , Bing D. H. (англ.) // Blood. — 1995. — Vol. 85, no. 9 . — P. 2471—2477. — .
- Davis B. R. , Yan Q. , Bui J. H. , Felix K. , Moratto D. , Muul L. M. , Prokopishyn N. L. , Blaese R. M. , Candotti F. (англ.) // Clinical immunology (Orlando, Fla.). — 2010. — Vol. 135, no. 1 . — P. 72—83. — doi : . — .
- Takimoto T., Takada H., Ishimura M., Kirino M., Hata K., Ohara O., Morio T., Hara T. Wiskott–Aldrich syndrome in a girl caused by heterozygous WASP mutation and extremely skewed X-chromosome inactivation: a novel association with maternal uniparental isodisomy 6. (англ.) // Neonatology : journal. — 2015. — 24 January ( vol. 107 , no. 3 ). — P. 185—190 . — doi : . — .
- ↑ . Дата обращения: 4 августа 2013. 4 июля 2013 года.
- ↑ 1 февраля 2014 года. , Resource of Asian Primary Immunodeficiency Diseases (RAPID)
- ↑ Jin, Y.; Mazza, C.; Christie, J.; Giliani, S.; Fiorini, M.; Mella, P.; Gandellini, F.; Stewart, D. et al. (2004). «Mutations of the Wiskott-Aldrich Syndrome Protein (WASP): hotspots, effect on transcription, and translation and phenotype/genotype correlation». Blood 104 (13): 4010. doi: . PMID от 18 ноября 2016 на Wayback Machine .
- ↑ . Дата обращения: 3 августа 2013. Архивировано из 18 февраля 2014 года.
- . Дата обращения: 9 мая 2019. 9 мая 2019 года.
- Sande, Merle A.; Wilson, Walter P. (2001). Current diagnosis & treatment in infectious diseases. New York: Lange Medical Books/McGraw-Hill. p. 361. ISBN 0-8385-1494-4 .
- Дата обращения: 21 августа 2013. 24 июля 2013 года.
- Derry, J. M. J., Ochs, H. D., Francke, U. Isolation of a novel gene mutated in Wiskott-Aldrich syndrome. Cell 78: 635—644, 1994. Note: Erratum: Cell 79: following 922, 1994. doi: . PMID от 18 ноября 2016 на Wayback Machine .
- Rosen F. S. , Cooper M. D. , Wedgwood R. J. (англ.) // The New England journal of medicine. — 1984. — Vol. 311, no. 5 . — P. 300—310. — doi : . — .
- Zhu Q. , Watanabe C. , Liu T. , Hollenbaugh D. , Blaese R. M. , Kanner S. B. , Aruffo A. , Ochs H. D. (англ.) // Blood. — 1997. — Vol. 90, no. 7 . — P. 2680—2689. — .
- Sullivan K. E. (англ.) // Current opinion in hematology. — 1999. — Vol. 6, no. 1 . — P. 8—14. — .
- ↑ . Резюме (pdf). orpha.net (2013). Дата обращения: 7 января 2017. 7 января 2017 года.
- Galy, A.; Roncarolo, M. G.; Thrasher, A. J. (2008). «Development of lentiviral gene therapy for Wiskott Aldrich syndrome» . Expert Opinion on Biological Therapy 8 (2): 181—190. doi: . PMC . PMID от 22 мая 2018 на Wayback Machine
- Frecha, C; M G Toscano , C Costa , M J Saez-Lara , F L Cosset , E Verhoeyen & F Martin (2008). «Improved lentiviral vectors for Wiskott-Aldrich syndrome gene therapy mimic endogenous expression profiles throughout haematopoiesis». Gene Therapy 15 (12): 930-41. doi: от 26 июля 2008 на Wayback Machine . PMID от 23 июля 2018 на Wayback Machine
- Boztug, K.; Schmidt, M.; Schwarzer, A.; Banerjee, P. P.; Díez, I. S. A.; Dewey, R. A.; Böhm, M.; Nowrouzi, A. et al. (2010). «Stem-Cell Gene Therapy for the Wiskott-Aldrich Syndrome» . New England Journal of Medicine 363 (20): 1918—1927. doi: . PMC от 4 июня 2016 на Wayback Machine . PMID от 23 июля 2018 на Wayback Machine
- Dewey, R.; Diez, I.; Ballmaier, M.; Filipovich, A.; Greil, J.; Gungor, T.; Happel, C.; Maschan, A. et al. (2006). «Retroviral WASP gene transfer into human hematopoietic stem cells reconstitutes the actin cytoskeleton in myeloid progeny cells differentiated in vitro». Experimental Hematology 34 (9): 1161—1169. doi: . PMID от 23 июля 2018 на Wayback Machine
- ↑ Aiuti, A.; Biasco, L.; Scaramuzza, S.; Ferrua, F.; Cicalese, M. P.; Baricordi, C.; Dionisio, F.; Calabria, A. et al. (2013). «Lentiviral Hematopoietic Stem Cell Gene Therapy in Patients with Wiskott-Aldrich Syndrome». Science. doi: .
- Worth A. J. , Thrasher A. J. (англ.) // Expert review of clinical immunology. — 2015. — P. 1—18. — doi : . — .
- Perry G. S. 3rd , Spector B. D. , Schuman L. M. , Mandel J. S. , Anderson V. E. , McHugh R. B. , Hanson M. R. , Fahlstrom S. M. , Krivit W. , Kersey J. H. (англ.) // The Journal of pediatrics. — 1980. — Vol. 97, no. 1 . — P. 72—78. — .
Ссылки
- // «Центр молекулярной генетики» при Медико-генетическом научном центре РАМН
- 2020-05-28
- 1