Interested Article - Транслокон
- 2020-12-17
- 3
Транслокон — большой белковый канальный комплекс, обеспечивающий транспорт белков через липидную мембрану . Применительно к эукариотам этот термин используется для обозначения белкового комплекса, который транспортирует синтезируемые полипептиды , обладающие соответствующим сигналом, внутрь эндоплазматического ретикулума (ЭПР) из цитозоля . Аналогичный процесс используется для встраивания незрелых белков в мембрану. У прокариот схожий белковый комплекс транспортирует полипептиды через плазматическую мембрану или встраивает мембранные белки в липидный бислой . Некоторые патогенные бактерии могут создавать транслоконы на мембране хозяина, что позволяет им доставлять свои факторы вирулентности непосредственно в целевые клетки .
Прокариотический транслокон
Бактериальный транслокон представляет собой тримерный белковый комплекс SecYEG, образованный тремя субъединицами : SecY, SecE и SecG. При помощи рентгеноструктурного анализа удалось выявить структуру гомологичного комплекса у архей . Длительное время велись дискуссии на тему того, может ли этот белок образовывать олигомеры в клетке. Однако, в последнее время учёные склоняются в пользу существования мономерной формы .
ЭПР-транслокон

Транслокон построен из белков Sec .
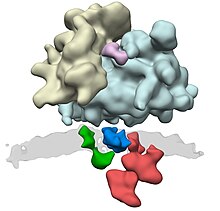
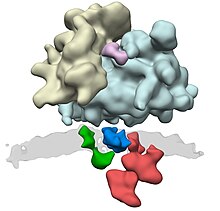
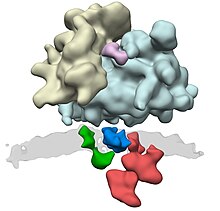
Комплекс транслокон состоит из нескольких больших белковых комплексов. Центральный элемент — это сам транслоконовый канал, гетеротример белка . К дополнительным компонентам относятся , комплекс TRAP и мембранный белок TRAM. Что касается остальных компонентов, таких как пептидаза, отрезающая сигнальную последовательность, и рецептор SRP-частица, то доподлинно неизвестно насколько прочно они связаны с комплексом и насколько такая связь длительна.
Синтезируемый на рибосоме белок узнаётся SRP-частицей, которая состоит из 7S РНК и 6 различных полипептидных цепей. SRP-частица связывается с рибосомой, что приводит к остановке трансляции белка. Затем SRP-частица связывается со своим интегральным рецептором, расположенным на поверхности ЭПР. Узнавание белка осуществляется по специальной N-концевой сигнальной последовательности, богатой гидрофобными остатками.
SRP-частица диссоциирует и трансляция продолжается во внутреннюю полость ЭПС через канал транслокона. Таким образом, синтезируемый белок проходит сквозь мембрану ЭПР во время его синтеза, то есть котрансляционно . Новосинтезированный полипептид проходит через канал в виде линейной пептидной молекулы. После окончания транслокации сигнальный пептид отрезается специальной пептидазой.
Помимо своей основной функции транслокон может встраивать в мембрану ЭПР интегральные белки, соблюдая при этом их правильную ориентацию. Механизм этого процесса не до конца ясен, но известно, что транслокон распознаёт особую стоп-последовательность из гидрофобных остатков, которые становятся трансмембранными доменами белка.
ЭПР-ретротранслокон
Транслоконы могут перемещать повреждённые белки из внутреннего пространства ЭПР обратно в цитоплазму. Вернувшись в цитозоль, белки деградируют в 26S протеосоме. Этот процесс носит название . Истинная природа такого ретротранслокона всё ещё остаётся загадочной.
Изначально существовало убеждение, что за ретроградный транспорт ответственен белок Sec61. Такая гипотеза предполагала, что транспорт через Sec61 может быть двунаправленным . Тем не менее, исследование структуры Sec61 не подтвердило такую гипотезу, и на эту роль были предложены несколько разных белков .
Примечания
- Pfeffer S., Dudek J., Gogala M., Schorr S., Linxweiler J., Lang S., Becker T., Beckmann R., Zimmermann R., Förster F. Structure of the mammalian oligosaccharyl-transferase complex in the native ER protein translocon (англ.) // Nature Communications : journal. — Nature Publishing Group , 2014. — No. 5 . — P. 3072 . — doi : .
- , с. 206.
- Johnson A.E.; van Waen M.A.;. The translocon: a dynamic gateway at the ER membrane (англ.) // : journal. — 1999. — doi : .
- Gold V. A., Duong F., Collinson I. Structure and function of the bacterial Sec translocon (англ.) // : journal. — 2007. — Vol. 24 , no. 5—6 . — P. 387—394 . — doi : . — .
- Mueller C. A., Broz P., Cornelis G. R. The type III secretion system tip complex and translocon (англ.) // : journal. — , 2008. — June ( vol. 68 , no. 5 ). — P. 1085—1095 . — doi : . — .
- X-ray structure of a protein-conducting channel (неопр.) . — 2004. — January ( т. 427 , № 6969 ). — С. 36—44 . — doi : . — .
- Alexej Kedrov. A single copy of SecYEG is sufficient for preprotein translocation (англ.) // : journal. — 2011. — Vol. 30 , no. 21 . — P. 4387—4397 . — doi : .
- Deshaies R. J., Sanders S. L., Feldheim D. A., Schekman R. Assembly of yeast Sec proteins involved in translocation into the endoplasmic reticulum into a membrane-bound multisubunit complex (англ.) // Nature : journal. — 1991. — Vol. 349 , no. 6312 . — P. 806—808 . — doi : . — .
- Römisch K. (англ.) // : journal. — , 1999. — December ( vol. 112 , no. 23 ). — P. 4185—4191 . — . 5 июня 2020 года.
- Hampton R. Y.; Sommer T.;. Finding the will and the way of ERAD substrate retrotranslocation (англ.) // Current opinion in cell biology : journal. — doi : .
Литература
- Ю. С. Ченцов. Цитология с элементами целлюлярной патологии. — М. : ООО Издательство «Медицинское информационное агентство», 2010. — 361 с.
См. также
Внешние ссылки
- 2020-12-17
- 3