Влияние Уильяма Шекспира
- 1 year ago
- 0
- 0

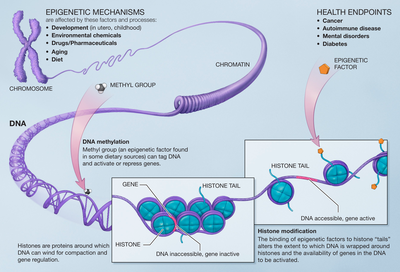
Эпигенетика изучает наследуемые изменения активности генов во время роста и деления клеток — изменения синтеза белков, вызванных механизмами, не изменяющими последовательность нуклеотидов в ДНК. Экспрессия (изменение активности генов) происходит посредством метилирования ДНК , гистонов и модификации микро-РНК . Эпигенетические изменения подобного рода могут наследоваться, а следовательно, влияют на эволюцию . На данный момент активно ведутся исследования, и уже стало известно, что эпигенетические механизмы оказывают большое влияние на все живые организмы .
Метилирование ДНК — это процесс, при котором на молекулу ДНК прикрепляются метильные группы. Метилирование изменяет активность сегмента ДНК без изменения самой последовательности. Гистоны — это белки, которые упаковывают и упорядочивают ДНК в нуклеосомы . Метилирование ДНК и модификация гистонов — это два механизма эпигенетики, которые регулируют экспрессию генов в растениях. Метилирование ДНК может быть стабильным процесом во время деления клеток, это позволяет передавать метилирование гена таким же генам в геноме . Метилирование ДНК, с помощью деметилазы, может стать обратимым процессом. Модификация гистонов также является обратимым процессом, при этом происходит удаление ацетильных гистонов с помощью деацетилазы . Межвидовые различия у растений, обусловленные факторами окружающей среды, связаны с различием между однолетними и многолетними видами растений. У каждого растения в итоге имеются свои индивидуальные адаптивные реакции.

Формы метилирования гистонов вызывают подавление определённый генов, эти изменения стабильно наследуются через митоз , но могут быть стёрты во время мейоза с течением времени. Время цветения под действием низких зимних температур у этого растения демонстрирует данный эффект метилирования. Метилирование гистонов участвует в подавлении экспрессии ингибитора (подавляющего вещества) цветения во время наступления холодов. У однолетней резуховидки Таля подобное метилирование гистонов стабильно наследуется через митоз, после возвращения в тёплый период. Это даёт растению возможность непрерывно цвести весной и летом, пока оно не состарится. Однако у многолетних родственных растений модификация гистона быстро исчезает после повышения температуры и позволяет наоборот увеличить действие ингибитора и ограничить цветение коротким интервалом, для многолетнего растения это способ сохранять питательные вещества для следующего года. Таким образом, эпигенетические модификации гистонов контролируют ключевой адаптивный признак резуховидки Таля и при этом модификация быстро меняется в ходе эволюции, являясь стратегий для успешного размножения.
Другие эксперименты проверили эпигенетические механизмы резуховидки Таля на чувствительность к засухе, недостатку питательных веществ. Для эксперимента подбирались растения с максимально сходными геномом. Растения помещаемые в разные условия показали значительную наследуемость адаптивной эпигенетики. Признаки, которые вырабатывались с помощью метилирования и были важными для выживания, успешно передавались при размножении. Метилирование ДНК давало разное распределение корней, засухоустойчивость, пластичность к разным видам питательны веществ. Это говорит о том, что только эпигенетическая вариация и адаптация приводит к быстрой эволюции.
Изменения в метилировании ДНК , вызываемые стрессом , наследуются у бесполых одуванчиков. Генетически сходные растения подвергались разным экологическим нагрузкам. а затем их потомки выращивались в спокойной экологически обстановке. Многие из экологических стрессов вызвали метилирование в геноме и эти модификации передавались следующим поколениям одуванчиков. Был сделан вывод что подобное наследование позволяет иметь высокую пластичность для выживания растений в любых условиях, от повышенной влажности, до засух и пожаров.
Парамутация гена b1 в кукурузе. Ген b1 кодирует основной фактор транскрипции, который участвует в синтезе антоцианов . Когда ген B-I экспрессируется, растения накапливает антоцианы в своих тканях, это приводит к пурпурной окраске растения. Аллель B-I имеет высокую экспрессию b1 приводящую к тёмной пигментации оболочек и шелухи. В то время как аллель B имеет низкую экспрессию b1 приводящую к низкой пигментации в этих тканях. Когда гомозиготные родители B-I скрещиваются с гомозиготными родителями B' потомство от них F1 демонстрирует низкую пигментацию. Это обусловлено «глушением» гена b1. Когда растения F1 скрещиваются, их потомки F2 показывают низкую пигментацию и имеют низкий уровень экспрессии b1.
Любое растение F2 при скрещивании с гомозиготным растением B-I, даст потомство которое будет иметь низкую пигментацию и экспрессию b1 . Отсутствие тёмно-пигментированных потомков линии F2 является примером не Менделевского наследования и дальнейшие исследования показали что аллель B-I преобразуется в B' с помощью эпигенетических механизмов, а не с помощью изменения последовательности ДНК и мутации генов.
Аллели B' и B-I идентичны по последовательности ДНК, но различаются по метилированию ДНК и по хромосомным взаимодействиям внутри ядра. Иногда спонтанное мутирование из B-I в B' имеет место, но разворот из B' в B-I (зелёный в фиолетовый) никогда не происходил, хотя за 50 лет проведено тысячи наблюдений за тысячами растений в тепличных и полевых экспериментах.
Так же зафиксированы экспериментально подтверждённые случаи эпигенетического наследования у риса. Рисовые побеги подвергались имитации засухи и показывали затем повышенную устойчивость к засухе на протяжении 11 поколений. Устойчивость «закалённых» рисовых побегов в засухе обусловлена с направленными изменениями метилирования ДНК по всему геному, эти изменения в итоге передавались по наследству в виде последующего метилирования у каждого поколения растений.
В другом эксперименте растения подвергались атаке травоядных гусениц в течение нескольких поколений, затем потомки этих растений демонстрировали большую устойчивость к поеданию гусеницами, ДНК в целом не менялось, но менялось опять таки метилирование генома в ДНК. А те растения которые росли без атак гусениц, подобными адаптациями не были наделены.
Сравнение паттернов метилирования CpG между людьми и приматами показал, что существует более 800 генов у человека, которые различаются по своим паттернам метилирования у орангутанов , горилл , шимпанзе и бонобо . Несмотря на то что у человека и названных обезьян одни и те же гены, различия в метилировании объясняют фенотипическую разницу между людьми и обезьянами и в целом фенотипическую изменчивость одних и тех же генов. Все эти гены так или иначе отвечают за физическое развитие человека и обезьян. В итоге человека от обезьян на генном уровне отличают не последовательности белков, а эпигенетические изменения генов.
На данный момент исследований понятно что у человека 171 ген метилирован не так, как у обезьян. 101 ген метилирован у шимпанзе и бонобо так же уникально. 101 ген метилирован у горилл и 450 генов метилированы у орангутанов. Например гены участвующие в регуляции кровяного давления и развитии полукруглого канала внутреннего уха высоко метилированы у человека, но не у обезьян. Так же известны 184 гена, которые полностью повторяются по строению белков у человека и шимпанзе, но отличаются по эпигенетическим настройкам. Именно метилирование в итоге делает вид человек разумный тем, кем он является, а не сам набор генов, который до 99 % повторяет набор генов у шимпанзе и других высших приматов. Это доказывает важную роль эпигенетики в эволюции человека и обезьян в целом .
Было доказано, что изменения в регуляторных элементах влияют на начальные участки транскрипции генов. 471 последовательность ДНК обогащена или обеднена в плане метилирования гистонов в H3K4 в при фронтальной коре шимпанзе, человека и макак. Среди этих последовательностей 33 являются избирательно метилированными в нейронном хроматине у детей и взрослых. Один из локусов который был метилирован — DPP10. Этот ген отвечает в том числе за адаптацию гоминидов связанную с более высокой скоростью нуклеотидных замен и ряд других регуляторных параметров, которые есть у человека и отсутствуют у других приматов. Эпигенетическая регуляция хроматина TSS определена как важное развитие в эволюции экспрессии генов в мозге человека. Эти гены играют свою роль одновременно в когнитивных процессах и неврологических расстройствах у людей
Анализ профилей метилирования сперматозоидов человека и приматов показал, что эпигенетическая регуляция и здесь активно работает. Клетки млекопитающих подвергаются перепрограммированию паттернов метилирования ДНК во время зародышевого состояния клетки, метилирование сперматозоидов человека и шимпанзе можно сравнить с метилированием в эмбриональных стволовых клетках . Найдено много различий в метилирование между клетками сперматозоидов и эмбрионально-стволовыми клетками. Многие из промоторов в сперматозоидах человека и шимпанзе имеют разное метилирование. Таким образом метилирование отличается у сперматозоидов и стволовых клеток в одном и том же организме, а также между сперматозоидами человека и приматов. Это может указывать на причины фенотипических различий между приматами и человеком разумным.
В 1998 году в Швейцарии на дрозофилах провели эксперимент. Учёный Ренато Паро из университета Базеля сделал следующее — у мух дрозофил в результате мутаций был жёлтый цвет глаз, в норме он красный. Но при повышении температуры среды, у дрозофил краснели глаза и затем их потомство рождалось тоже с красными глазами. Выяснено что у мух активировался хромосомный элемент, он менял цвет глаз. Это пример наследования детьми признаков, полученных при жизни родителями. Так же красные глаза сохранялись и при дальнейшем размножении в течение ещё четырёх поколений, но эти поколения уже не подвергались тепловому воздействию.
У пчёл Apis mellifera изменение фенотипа на эпигенетическом уровне происходит с помощью изменения типа питания. Рабочие пчёлы кормят личинки маточным молочком . Но при этом варьируется длительность кормления. Те личинки которых дольше кормят маточным молочком, становятся королевами. Внутри этих пчёл происходят эпигенетические изменения отличающие их от простых рабочих пчёл. У королев увеличен синтез ювенильного гормона и активизации сигнального пути TOR, а также усилена модуляция инсулинового сигнального пути. Доказательство того что именно эпигенетические механизмы делают пчелиные особи столь разными — королева откладывает абсолютно идентичные яйца в сотах . Они генетически не отличаются друг от друга.

Из неоплодотворённых яиц вырастают трутни . Из оплодотворённых с помощью длительности питания молочком получаются либо королевы, либо рабочие пчёлы. Королевы в итоге имеют больший размер, живут гораздо дольше чем рабочие медоносные пчёлы. Разница в длительности жизни королевы и рабочей пчелы достигает 100 раз, рабочие пчёлы живут 15 — 38 суток в летний период, 150—200 в зимнее время. Королева живёт 1 — 2 года. Именно питание на стадии личинки настолько сильно влияет на насекомых и наглядно доказывает важность прижизненных эпигенетических изменений в геноме. У пчёл маточное молочко стимулирует активное метилирование ДНК , в различных таксонах метилирование участков ДНК, обогащенных CG-парами в регионе промотора гена, приводит к ингибированию его транскрипции .
В эксперименте с пчёлами экспрессия гена Dnmt3 была подавлена с помощью миРНК . Данный ген кодирует фермент , который в свою очередь катализирует метилирование ДНК. В итоге 72 % вылупившихся самок имели признаки королев. Выявлено что в мозге рабочих пчёл и королев по разному метилировано более 550 генов. Наибольшие различия выявлены в сигнальных путях инсулина и ювенильного гормона , а также гена киназы анапластической лимфомы. Ген киназы играет важную роль в регуляции метаболизма . У королев уровень метилирования ДНК увеличивался со вторых до четвёртых суток личиночной стадии развития. У рабочих личинок метилирование увеличивалось во всех стадиях развития. Более 4 500 генов в итоге по разному метилированы и короле и рабочих особей. В том числе резкие различия выявлены в генах отвечающих за гипоксический стресс . У рабочих пчёл выявлен более высокий уровень транскрипции факторов гипоксического сигнального пути — HIFα/Sima, HIFβ/Tango и PHD/Fatig. У королев более высокий уровень экспрессии двух генов, отвечающих за процесс репарации и предотвращения окислительных повреждений, у рабочих пчёл работа этих генов напротив снижена.
Опыты на мышах проведённые в Дюкском университете Рэнди Джиртлом и Робертом Уотерлендом. Учёные встроили искусственный ген в обычных мышей, из за него они рождались жёлтыми, склонными к ожирению и болезням — мыши агути. Затем поколению таких мышей, уже беременным стали добавлять в корм фолиевую кислоту , витамин B12 , холин и метионин . У больных мышей в итоге родилось здоровое потомство, однако ген делавший их агути не исчез из генома, он сохранился но был заглушен эпигенетическими механизмами, а эпигенетика в свою очередь активно работает при введении в питание вышеназванных веществ. Смена рациона оказалась способной изменить эпигенетику генома и нейтрализовать вредную мутацию в генах. Действие изменений сохранилось в нескольких следующих поколениях, при этом питание второму и последующим поколениям сделали обычным.
Канадские биологи Майкл Мини и его коллеги, из университета Макгилла , провели эксперимент получивший прозвище «вылизывание и уход». Они изучили влияние материнской заботы о детёнышах у крыс. Крысят разделили на две группы. Часть из родившихся крысят отнимали от матерей сразу после рождения. Не получавшие материнской заботы (в том числе вылизывание) крысята поголовно вырастали нервными, необщительными, агрессивно-трусливыми. Все крысята из тех, кого оставили с матерью развивались как и положено крысам- энергичными, обучаемыми, социально активными. Возникли вопросы на каком уровне происходит реакция на заботу и не заботы у крыс. Ответ был получен после анализа ДНК. У крысят которых отнимали от матерей происходили негативные эпигенетические изменения в геноме, в особенности отвечающие за область мозга гиппокамп . В гиппокампе оказалось снижено число рецепторов к стрессовым гормонам. Отсюда неадекватная реакция нервной системы на любые внешние раздражители — звук, температура, другие крысы. Гиппокамп всё время выдавал избыточное количество стрессовых гормонов . В отличие от них, у крысят воспитанных матерями гиппокамп работал нормально
Так же у крыс выявлены примеры разного поведения матерей. Есть матери, которые активно заботятся о крысятах, есть те, кто наоборот мало времени уделяет детям. В итоге те крысы, которые вырастали у заботливой матери, получали много вылизываний, чистки, кормления, вырастали менее боязливыми, с лучшими задатками к обучению и, значит, с большей адаптацией к выживанию и дальнейшему успешному размножению. Напротив, излишне нервные крысята от не заботливых матерей, имеют низкие шансы на успешное размножение . Наиболее важный периодом оказалась первая неделя после рождения, в этот промежуток эпигенетическая система крысят наиболее гибкая и подвержена изменениям в геноме и в итоге оказывает влияние на надпочечники , гипоталамус и гипофиз . Крысята от заботливых матерей, помещаемые в стрессовые ситуации (подвешивание за хвост, опускание в ёмкость с водой) подолгу не сдавались, стараясь выйти из неудобного, опасного положения до последнего Крысята не получавшие ласки и заботы быстро впадали в апатию, отчаяние.
В ходе исследования, с помощью бисульфатного секвенирования , учёные вышли на регуляторную область глюкокортикоидного рецептора — экзон 17. У крысят от заботливых матерей отсутствовало метилирование цитозина в составе экзона 17. Из за этого ген активно транскрибируется , а уровень гистонов высокий и это говорит об активном хроматине . У крысят лишённых заботы цитозин в экзоне 17 метилирован и экспрессия мРНК в нём снижена .
Следующий эксперимент показал что материнское поведение напрямую влияет на эпигенетические изменения в экзоне 17. В период 12 часов после рождения, крысят забирали у матерей, часть отдавали заботливым крысам- мачехам , часть не заботливым. У заботливых мачех отсутствовало метилирование цитозинов в составе экзона 17 и не отличалось от тех крысят, которых растила родная мать. У не заботливых мачех метилирование цитозина в экзоне 17 было таким же, как у не заботливых родных матерей, цитозин был подавлен и экзон 17 работал намного хуже. Однако попытка просто компенсировать метилирование с помощью химических веществ (в частности с помощью ингибитора деацетилазы TSA) не даёт эффекта, это значит что материнская забота запускает или не запускает намного больший по объёму каскад эпигенетических реакций в организме и он не ограничен только действием на цитозин в экзоне 17, а шире по спектру действий.
При исследовании схемы передачи изменений в эпигенетике по полу крыс, выяснилось что наибольшее влияние получается у самцов, которых вырастили не заботливые матери. Самки от не заботливый матерей лучше справлялись с заданиями и не показывали депрессивности. Предполагается что половые гормоны матерей по разному действуют на самцов и самок. Затем крысят отлучали от матерей на ранних сроках вскармливания, в основном самцы показывали симптомы тревожного поведения. Этих самцов скрещивали с нерожавшими самками и в итоге родившиеся крысята получали нормальный уход и развиваются в пределах нормы. Однако во втором поколении признаки депрессии и тревожности начинали демонстрировать уже самки, а самцы нет, они были в норме. В третьем поколении уже самцы вновь показали депрессивность и тревожность. Это говорит о прерывистом, но достаточно долгом наследовании депрессии, как минимум на 4 поколения вперёд и является примером эпигенетического наследования признаков приобретаемых при жизни особей. Цитата:
" Гиперметилирование CpG-островков в регуляторных регионах генов MeCP2, CB1 и гипометилирование регуляторной области гена CRFR2 приводили к уменьшению экспрессии мРНК этих генов. При этом не наблюдалось изменений в метилировании регуляторных областей генов серотонинового рецептора (играющего значительную роль в развитии депрессии ) и моноамиоксидазы (катализирующей расщепление серотонина ). Изменения уровней метилирования, происходящие одновременно в разных генах, позволяют полагать, что множество генов оказывает влияние на поведение особей.
Результаты этого исследования свидетельствуют о том, что постнатальный стресс оказывает влияние не только на детей, но и на более отдаленных потомков . "

Для людей исследования эпигенетических процессов осложняются рядом факторов. Невозможно напрямую просто ставить эксперименты. Так же людское сообщество это сложный набор смешивания генов, влияния климата, культурных факторов, стресса , пищевых особенностей. Классическая наследственность по ДНК может точно показывать фенотипические особенности людей. Но она не может полностью объяснить почему дети порой наследуют от родителей признаки, явно приобретаемые при жизни и передающиеся затем при размножении.
Самый массовый и точный на сегодняшний день проект — исследования эпигенетики на примере Голландской голодной зимы 1944—1945 года . Удобство данного примера в том, что точно известны люди его пережившие, длительность времени которое люди голодали, плюс точно очерченный ареал голода. Голод пережили 4,4 млн человек, он продолжался с ноября 1944 до мая 1945. Дети которых вынашивали во время голода, уже после рождения были меньше чем рождённые за год до голода. И снижение размеров у людей продолжалось два поколения. У этих детей обнаружен повышенный риск непереносимости глюкозы во взрослом возрасте. Исследования выявили метилирование ДНК у этих людей, все они родились от матерей выносивших их в период голодной зимы. Есть предположения что метилирование вызвало замедление работы гена PIM3 который отвечает за скорость метаболизма и чем ген замедленнее, тем замедленнее метаболизм. В целом данные факты получили название — синдром голландской голодной зимы.
Дети и внуки от матерей и бабушек, переживших этот голод, имели больше болезней обмена веществ, сердечно сосудистые заболевания. У них чаще встречалась шизофрения , шизотипические и неврологические нарушения. Эффекты голода не одинаковы у всех детей и различаются по степени родства и линиям родства.
1 — Больший индекс массы тела у мальчиков в 9 лет, это передалось от отцов.
2 — У дочерей в 9 лет не было повышенного индекса массы тела, но они раньше начинали курить .
3 — Голод деда по отцовской линии связан только со смертностью внуков (мальчиков), но не внучек (девочек).
4 — Голод бабушки по отцовской линии оказался связан со смертностью внучек.
5 — Плохое питание у отца и хорошее у матери связаны с более низким риском сердечно сосудистых заболеваний у детей.
В некоторых случаях наблюдалась потеря экспрессии в геноме, это приводило к синдрому Прадера-Вилли и синдрому Ангельмана . При исследовании выяснилось что это вызвано эпигенетическими изменениями на обоих аллелях , но не генетической мутацией ДНК. Во всех 19 зафиксированных случаях подобных патологий, они чётко привязаны к степени родства детей и предков переживших голод. В частности отцы несли хромосому с материнской мутировавшей меткой SNURF-SNRPN, а она в свою очередь унаследована отцами от бабушки по отцовской линии. Эпигенетические изменения в гене MLH1 зафиксированы у двух человек, но самой мутации в гене не было и потому заболевание в виде наследственный неполипозного колоректального рака не зафиксировано, а в случае мутации гена это заболевание случается у людей.
Установлено что отцовская линия отвечает за регулирование веса у дочерей при рождении потенциальный риск развития у них рака молочной железы .
У детей переживших в детстве насилие, жестокое обращение, сексуальное насилие или демонстративное пренебрежение ребёнком со стороны родителей, наблюдается эпигенетическая модификация экспрессии глюкокортикоидных рецепторов . Данные рецепторы играют жизненно важную роль в активности гипоталамуса , гипофиза и надпочечников . Эксперименты на животных указывают что эпигенетические изменения зависят от отношений матери и ребёнка. Так же дети наследуют от матерей эпигенетические изменения на стадии вынашивания . Если матери в период беременности подвергались насилию, стрессам, то их дети имели эпигенетические изменения гена отвечающего за глюкокортикоидные рецепторы и были склонны к высокому уровню тревоги и легче поддавались стрессам. Воздействие вещества на женщин, приводит к тому что внуки вплоть до третьего поколения имеют повышенный риск развития синдрома дефицита внимания и гиперактивности .
У людей зафиксировано коррелирование месяца рождения и предрасположенность к диабету второго типа. При этом разрыв между временем влияния факторов при рождении ребёнка и началом самой болезни составляет в среднем 50-60 лет. Питер Глюкман и Марк Хансон сформулировали эту проблему так — в развивающемся организме происходит эпигенетическая адаптация к условиям среды, которые воздействуют на вынашивающую ребёнка мать. Но в случае переезда или смены условий среды организм ребёнка «ошибается» и возникают риски болезней. Так, если ребёнок во время внутриутробного развития имеет недостаток питания, в организме происходят метаболические процессы, эпигенетика стимулирует гены запасать ресурсы впрок. Такой ребёнок после рождения, если будет продолжаться голод, имеет большие шансы выжить, но если голода нет, у него резко возрастает риск ожирения, диабета, болезней сердца.
Эпигенетические механизмы (в особенности метилирование ) регулировки активности генов участвуют во многих процессах связанных с развитием и формированием всего организма человека. Инактивация Х-хромосом у эмбриона задача для эпигенетики, это связано с тем что у самок млекопитающих две копии половой хромосомы Х, а у самцов одна хромосома Х и одна Y . Y хромосома меньше по размеру и несёт меньшее количество генетической информации, поэтому с помощью метилирования одна женская Х хромосома отключается, это уравнивает самок и самцов в передаче генетики потомству и не допускает перекоса в наследовании.
Как известно развитие зародыша начинается с одной клетки-зиготы, затем на стадии 32-х клеток образуется бластоциста, она состоит из трофобласта и эмбриобласта, далее следует имплантация в стенку матки. Без эпигенетики было бы невозможно с помощью просто ДНК и РНК точно определить симметричность организма, в какую сторону будет расти голова и в какую ноги. В целом эпигенетика отвечает за эти процессы и за равномерное смешивание материнского и отцовского геномов в зародыше. На стадии зародыша в 50 — 100 клеток, в каждой клетке хромосома (отцовская или материнская) отключается метилированием случайно и уже остаётся не активной при дальнейшем развитии клетки.
Зародыш на стадии первичного развития состоит из универсальных эмбриональных клеток , они могут стать любой клеткой организма — клетками мозга или клетками ногтей. Эпигенетическое регулирование генома определяет какая клетка или ткань начнёт формироваться и где именно. Любой сбой в работе эпигенетики ведёт к патологиям или смерти эмбриона, при этом само ДНК может быть в норме, без патологий и мутаций. Недостатком метилирования является то, что оно напрямую завязано на питание отца и матери, особенно в период зачатия и вынашивания плода. Эмоциональные потрясения, активность мозга матери, температура, голод, стрессы оказывают сильное влияние на эпигенетику и метилирование ДНК у эмбриона и затем ребёнка.
Эпигенетика отвечает за формирование зародышевых листков, это первая стадия разделения клеток на будущие ткани и органы. В итоге на финальной стадии эпигенетика разделит клетки на почти двести типов. Все они результат включения и выключения генов в строго определённый промежуток времени. В итоге гены выступают в роли полностью контролируемых программ, тогда как эпигенетические механизмы регулируют эти программы.
Эпигенетические механизмы — модификация гистонов через и деацетилтиование остатков лизина, ремоделирование хроматина являются критическим важными регуляторами иммунитета у всех людей. Эпигенетика отвечает за все реакции всех иммунных клеток на разные угрозы. В контексте врождённого иммунитета эпигенетика регулирует разделение врождённых клеток от миелоидных и отвечает за фенотипические вариации в разделённых клетках. Иммунные клетки реагируют на антигены и инфекции посредством транскрипционных каскадов. Эти каскады реакций регулируются эпигенетически, через модификации гистонов, ремоделированием хроматина на уровне генов, микро РНК и метилированием ДНК. В итоге происходит экспрессия цитокинов и противоинфекционных молекул в ответ на угрозу. Метилирование ДНК в контексте врождённого иммунитета изучено меньше чем ацетилирование гистонов. Известно что после болезней просиходят значительные изменения метилирования ДНК в клетках врождённого иммунитета. Действие вакцин основано на эпигенетике организма.
Эпигенетическое наследование может влиять на приспособленность в том случае, если оно предсказуемо меняет признаки в организме при естественном отборе. Доказано что стимулы от окружающей среды влияют на изменение эпигенов. Подобная система относительно схожа с тем, что предполагал Ламарк, но не отменяет Дарвиновскую систему естественного отбора. Эпигенетика даёт организму преимущество при резком изменении окружающей среды (от голода до температур) и позволяет более успешно выживать на малых и средних временных масштабах. При этом дарвиновский отбор будет действовать на все организмы и если те или иные эпигенетические изменения не будут полезными, особи не оставят потомства.
У растений Linaria vulgaris , ген Lcyc контролирует симметрию цветка. Линней описал радиально симметричные цветки-мутанты, они возникают при сильном метилировании гена Lcyc. Для опылителей и форма и симметричность цветов важный фактор, поэтому такие нарушения в гене Lcyc вызывают вредные последствия для растений. У животных так же эпигенетика не всегда приносит полезные изменения. Унаследованные признаки могут приводить повышенной восприимчивости к болезням. В частности эпигенетические изменения у людей приводят к онкологии. Паттерны метилирования опухолей в промоторах генов положительно связаны с передачей онкологии по наследству, внутри семей. Метилирование гена MSH2 у людей связано с ранним началом колоректерального рака и рака эндометрия.
В качестве эксперимента семена растения Arabidopsis thaliana демитилировали, это вызвало значительное повышение смертности, замедленный рост, замедленное цветение и низкое количество плодов. Данные факты указывают на то что эпигенетика может повышать приспособленность организмов. олученные в результата воздействия окружающей среды реакции на стресс наследуются и положительно связаны с приспособленностью организмов. У животных таких как мыши эпигенетика влияет на общинное гнездование, увеличение родительской заботы и социальных контактов, это улучшает шансы потомства на выживание.
Наследственные эпигенетические эффекты на фенотипы хорошо документированы у бактерий, протистов, грибов, растений, нематод, плодовых мух. В целом по современным наработкам в экспериментах, для растений эпигенетика играет большую роль чем для животных. У животных на ранней стадии (зародышевой) труднее идёт наследование по эпигенетическому механизму, в то время как у растений и грибов соматические клетки могут включаться в зародышевое развитие. Есть теория что чем крупнее животное, чем дольше оно живёт, тем менее эффективно эпигенетическое наследование, в силу большего по времени разрыва между сменой поколений. К примеру у мышей явно прослеживаются полезные эпигенетические изменения, влияющие на выживаемость и быструю адаптацию к новым условиям. Однако чем крупнее организм, тем ему в целом сложнее сменить среды обитания, тип питания, половое поведение и так далее.
Эпигенетические открытия не противоречат ни теории Ламарка, ни теории Дарвина, а наоборот связаны с ними обеими. Например Ламарк постулировал что факторы окружающей среды влияют на изменения фенотипов. Сегодня понятно что это так и есть, при воздействии среды, особенно в экстремальных формах (засуха, голод) усиливаются эпигенетические изменения в геноме и в зародышевых линиях, это увеличивает фенотипическое разнообразие. Теория Дарвина постулировала что естественный отбор усиливает способность выживших популяций к успешному размножению, причём выживают всегда наиболее быстро приспособившиеся к изменившимся условиям среды. Дарвинизм таким образом согласуется с пластичностью эпигенетических изменений между поколениями и постоянным нарастанием фенотипического разнообразия в результате того что эпигенетика усиливает передачу по наследству приобретаемых при жизни признаков.
Наибольшую пользу от эпигенетической передачи признаков извлекают организмы находящиеся на одном месте. Чем привязаннее организм к одной точке, чем ниже у него способность к рассеиванию генов по другим точкам и чем проще у него поведение, тем важнее ему максимально передавать потомкам наработанные при жизни эпигенетические признаки. Это объясняет то, почему в мало изменяющейся среде меньше эпигенетически активных организмов меньше, а в активно изменяющейся среде их больше.