Энантиомеры
- 1 year ago
- 0
- 0
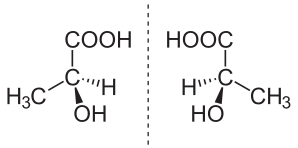
Энантиомеры ( др.-греч. ἐνάντιος «противоположный» + μέρος «мера, часть») — пара стереоизомеров , представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве . Классической иллюстрацией двух энантиомеров могут служить правая и левая ладони : они имеют одинаковое строение, но различную пространственную ориентацию.
Существование энантиомерных форм связано с наличием у молекулы хиральности — свойства не совпадать в пространстве со своим зеркальным отражением.
В ахиральной (симметричной) среде [ уточнить ] энантиомеры имеют одинаковые химические и физические свойства, кроме способности вращать плоскость поляризации плоскополяризованного света на одинаковую величину угла, но в противоположных направлениях. Данное свойство энантиомеров получило название оптической активности (оптической изомерии, а сами вещества — оптических изомеров).
Большинство хиральных природных соединений ( аминокислоты , моносахариды ) существует в виде одного энантиомера. Понятие энантиомерии играет важную роль в фармацевтике , поскольку разные энантиомеры лекарственных веществ , как правило, имеют различную биологическую активность .
Свойством энантиомерии обладают хиральные соединения, то есть содержащие элемент хиральности (хиральный атом и др.). Однако, встречаются молекулы (так называемые мезоформы), содержащие несколько симметрично расположенных элементов хиральности, но в целом не являющиеся хиральными. Примером может служить мезовинная кислота , не имеющая энантиомеров.
Энантиомер именуется по направлению, в котором его раствор вращает плоскость поляризации света. Если вращение происходит по часовой стрелке, то такой энантиомер называется (+), или правовращающим. Его оптический антипод именуется (–), или левовращающим. Данная номенклатура появилась до того, как были открыты методы установления абсолютной конфигурации энантиомеров. Она является эмпирической и напрямую не связана с расположением атомов в пространстве.
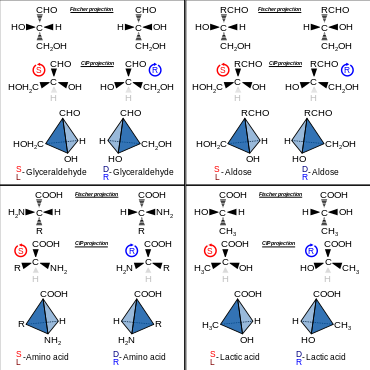
R / S -Номенклатура является наиболее широко используемой в данное время, поскольку позволяет охарактеризовать энантиомер по его абсолютной конфигурации . Это стало возможным благодаря открытию рентгеноструктурного анализа , позволяющего установить точное пространственное расположение атомов в молекуле.
Данный вид номенклатуры основывается на присвоении хиральному атому углерода обозначения R или S на основании взаимного расположения четырёх связанных с ним заместителей. При этом для каждого из заместителей определяют старшинство в соответствии с правилами Кана — Ингольда — Прелога , затем молекулу ориентируют так, чтобы младший заместитель был направлен в сторону от наблюдателя, и устанавливают направление падения старшинства остальных трёх заместителей. Если старшинство уменьшается по часовой стрелке, то конфигурацию атома углерода обозначают R ( англ. right — правый). В противоположном случае конфигурацию обозначают S ( лат. sinister — левый) .
Если соединение содержит лишь один хиральный центр, то его конфигурация указывается в названии в виде приставки. Если в соединении находится несколько стереоцентров, нужно обозначить конфигурацию каждого.
R / S -Номенклатура не имеет непосредственной связи с (+/–)-обозначениями. Например, R -изомер может быть как правовращающим, так и левовращающим, в зависимости от конкретных заместителей при хиральном атоме.
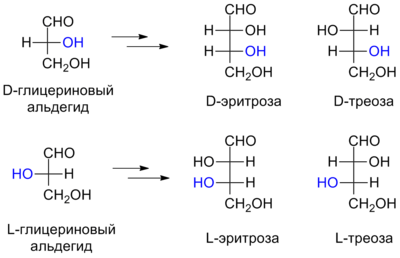
D/L-Номенклатура была введена Э. Фишером для описания относительной конфигурации моносахаридов. Она основана на конфигурации глицеринового альдегида , существующего в виде двух энантиомеров, из которых путём последовательных реакций наращивания углеродной цепи можно получить производные моносахариды (тетрозы, пентозы, гексозы и т. д.). Поскольку в ходе наращивания углеродной цепи стереоцентр глицеринового альдегида не затрагивается, все производные сахара, по Фишеру, получают то же обозначение относительной конфигурации, что и исходный глицериновый альдегид. Обозначения для энантиомеров глицеринового альдегида были присвоены Фишером произвольно.
В настоящее время современные методы установления структуры соединений позволяют характеризовать конфигурацию моносахаридов, не сравнивая их с глицериновым альдегидом. Однако, d/l -номенклатура традиционно сохраняется в названиях сахаров и аминокислот. Обозначения d или l связаны с расположением функциональной группы (гидроксильной для сахаров и аминогруппы для аминокислот) нижнего стереоцентра в проекции Фишера для данного соединения. Если функциональная группа располагается слева от углеродного скелета, то такой энантиомер обозначают символом l ( лат. lævus — «левый», левовращающий изомер), если же она располагается справа, то это d -энантиомер ( лат. dexter — «правый», правовращающий изомер) . Примеры отображения L- и D- изомеров в структурных химических формулах:
В биологии, биохимии и медицине, традиционно чаще используются обозначения D- и L- в силу применения в них исторический латинского языка в терминологии.
Энантиомеры идентичны по физическим свойствам, например, они имеют одинаковую температуру кипения или плавления , показатель преломления , плотность и т. д. Они могут быть различены лишь при взаимодействии с хиральной средой, например, световым излучением. Световая волна может быть представлена в виде левой и правой циркулярно поляризованных составляющих, которые в среде энантиомера распространяются с различными фазовыми скоростями , за счёт чего возникает вращение плоскости поляризации . В противоположных энантиомерах (оптических антиподах) бо́льшую скорость имеет та или иная циркулярно поляризованная составляющая, поэтому направление вращения плоскости поляризации для энантиомеров противоположно .
Энантиомеры характеризуют величиной удельного вращения, которая рассчитывается как величина вращения, делённая на длину оптического пути и концентрацию раствора энантиомера.
Энантиомеры одинаково ведут себя в химических реакциях с ахиральными реагентами в ахиральной среде. Однако, если реагент, катализатор либо растворитель хиральны, реакционная способность энантиомеров, как правило, различается . Типичным примером являются лекарственные соединения , взаимодействующие с хиральными компонентами организма ( белки , ферменты , рецепторы ). Обычно, активность проявляет лишь один энантиомер лекарства, в то время как другой энантиомер активности не проявляет.
Рацемат (рацемическая смесь) — эквимолярная смесь энантиомеров. Поскольку оптическое вращение является аддитивной величиной, вращение одного энантиомера компенсируется вращением второго энантиомера, и суммарное вращение рацемической смеси равно 0. По номенклатуре ИЮПАК рацематы обозначают приставками (±)-, rac - (или racem -) или символами RS и SR .
В результате химического синтеза , как правило, образуются именно рацемические смеси. Для получения индивидуальных энантиомеров или энантиомерно обогащённых продуктов необходимо использовать методы стереоселективного синтеза либо .
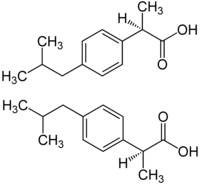
Молекула противовоспалительного препарата ибупрофена имеет один стереоцентр в α-положении к карбоксильной группе , поэтому она существует в виде двух энантиомеров. Ибупрофен, производимый в промышленности, является рацемической смесью . Установлено, что биологической активностью обладает лишь один энантиомер — ( S )-(+)-ибупрофен. В то время как его оптический антипод ( R )-(–)-ибупрофен в организме неактивен. В связи с этим стало коммерчески доступно аналогичное лекарственное средство, представляющее собой энантиомерно чистый ( S )-(+)-ибупрофен, т. н. дексибупрофен. В ходе дальнейших исследований было обнаружено, что в организме человека присутствует изомераза , способная превращать неактивный ( R )-(–)-ибупрофен в активный ( S )-(+)-ибупрофен .
Другим примером могут служить антидепрессанты циталопрам и эсциталопрам . Циталопрам является рацемической смесью ( R )-циталопрама и ( S )-циталопрама. Эсциталопрам является индивидуальным ( S )-энантиомером. Было показано, что эсциталопрам более эффективен при лечении депрессивных состояний , чем аналогичная доза циталопрама .