Фруктозо-2,6-бисфосфат
- 1 year ago
- 0
- 0
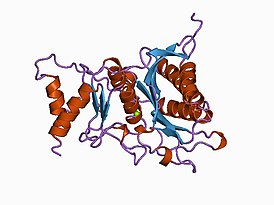
| Фруктозо-1,6-бисфосфатаза в твёрдом состоянии | |
|---|---|

|
|
| Идентификаторы | |
| Символ | FBPase_2 |
| Pfam | |
| Pfam clan | |
| Доступные структуры белков | |
| Pfam | |
| PDB | ; ; |
| Фруктозо-1,6-бисфосфатаза | |
|---|---|
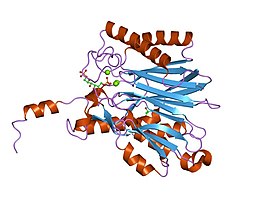
Кристаллическая структура фруктозо-1,6-бисфосфатазы |
|
| Идентификаторы | |
| Символ | FBPase_3 |
| Pfam | |
| Доступные структуры белков | |
| Pfam | |
| PDB | ; ; |
Фруктозо-1,6-бисфосфатаза , также Фруктозо-1,6-дисфосфатаза ( ФБФ-аза , FBP сокр. от англ. Fructose 1,6-bisphosphatase , шифр КФ ) — фермент из группы фосфатаз (класс гидролазы ), катализирующий реакцию гидролиза фруктозо-1,6-бисфосфата до фруктозо-6-фосфата с образованием неорганического фосфата по реакции:
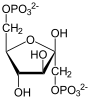 + H
2
O
+ H
2
O
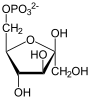 + P
i
+ P
i
Данная реакция протекает в глюконеогенезе и цикле Кальвина , которые относят к анаболическими процессами. Фруктозо-1,6-бисфосфатаза катализирует обратную реакцию, по отношению к реакции, катализируемой фосфофруктокиназой в процессе гликолиза . Эти ферменты катализируют реакции только в одном направлении, и регулируются метаболитами, такими как фруктозо-2,6-бисфосфат , так что высокая активность одного из двух ферментов сопровождается низкой активностью другого. Известно, что фруктозо-2,6-бисфосфат способен также аллостерически связываться с фруктозо-1,6-бисфосфатазой, тем самым ингибируя её, но активирует при этом фосфофруктокиназу. ФБФ-аза участвует в различных метаболических путях и встречается у большинства организмов. ФБФ-азе для катализа в качестве кофакторов требуются ионы двухвалентных металлов (предпочтительнее Мg 2+ и Мn 2+ ), при этом ионы лития Li + являются мощными ингибиторами .
Ген, кодирующий данные фермент — , локализован на 9-ой хромосоме .
Было отмечено, что фолд фруктозо-1,6-бисфосфатазы свиньи идентичен инозитол-1-фосфатазе (ИМФ-азе) . Инозитолполифосфат 1-фосфатаза (ИПФ-аза), ИМФ-аза и ФБФ-аза имеют мотив последовательности (Asp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Ser), который, как было показано, связывает ионы металлов и участвует в катализе . Этот мотив также встречается в дистанционно связанных грибковых, бактериальных и дрожжевых гомологах ИМФ-азы. Было высказано предположение, что эти белки определяют древнее структурно-консервативное семейство, вовлечённое в различные метаболические пути, включая сигнализацию инозитолом, глюконеогенез , усвоение сульфата и, возможно, метаболизм хинона .
Три различные группы фруктозо-1,6-бисфосфатазы были идентифицированы у эукариот и бактерий (ФБФ-азы I—III) . Ни одна из этих групп до сих пор не была найдена в археях , однако, новая группа ФБФ-аз (ФБФ-азы IV), которая также проявляет свойства инозитол монофосфатазы, недавно выявлена у архей .
Новая группа ФБФ-аз (ФБФ-азы V) встречается в термофильных археях и гипертермофильных бактериях Aquifex aeolicus .
Фруктозо-1,6-бисфосфатаза также играет ключевую роль в лечении сахарного диабета 2 типа . Это заболевание характеризуется гипергликемией (повышенной концентрацией глюкозы в крови), которая вызывает множество серьёзных проблем, и в лечении часто приходится акцентировать внимание на снижение уровня сахара в крови . Усиленный глюконеогенез в печени является одной из основных причин перепродукции глюкозы у этих больных, и поэтому ингибирование глюконеогенеза является разумным способом для лечения сахарного диабета 2 типа.
Мутации в гене FBP1 могут приводить к наследственной недостаточности фруктозо-1,6-бисфосфатазы. Это аутосомно-рецессивное заболевание, характеризующееся нарушениям процесса глюконеогенеза, которые приводят к гипогликемии , лактатацидозу , гипервентиляции , судорогам и гипогликемической коме . Особенно опасны эти проявления среди новорожденных, так как среди них наблюдается высокая летальность.