Гликолиз
- 1 year ago
- 0
- 0
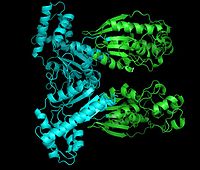
Фосфофруктокиназа-2 ( ФФК-2 ) или фруктозо-2,6-бисфосфатаза ( ФБФ-2 ) — бифункциональный фермент , регулирующий процессы гликолиза и глюконеогенеза в теле человека. Этот белок является димером, в котором каждый мономер, в зависимости от внешних условий, может действовать как киназа или фосфатаза . Регулируется глюкагоном и инсулином .
Каждый мономер данного белка разделён на два функциональных домена . Киназный домен расположен на N-конце . Он состоит из шести-тяжевого , в котором пять параллельных тяжей и один антипараллельный тяж, окружённый шестью альфа-спиралями . Этот домен содержит нуклеотид-связывающую укладку ( англ. nucleotide-binding fold ) на C-конце первого β-тяжа , что объединяет его со структурой аденилаткиназы.
Фосфатазный домен расположен на C-конце . Он схож с белками других семейств, таких как фосфоглицератмутазы и кислые фосфатазы Этот домен имеет смешанную α/β-структуру, в которой присутствует шести-тяжевый центральный β-лист и дополнительный α-спиральный субдомен, предположительно покрывающий активный центр фермента молекулы . Наконец, N-конечный регион модулирует активности фосфофруктокиназы-2 и фруктозо-2,6-бисфосфатазы и стабилизирует димерную форму фермента .
Когда уровень глюкозы понижен, в кровь выпускается глюкагон, что активирует сигнальный каскад цАМФ-зависимого пути . В печени протеинкиназа A фосфорилирует Ser -32 этого бифункционального фермента (но этого не происходит в скелетных мышцах), что вызывает понижение киназной активности и стимулирует фосфатазную активность . В результате происходит снижения уровня фруктозо-2,6-бисфосфата , которая в норме стимулирует активность фосфофруктокиназы-1 , что и приводит к ослаблению гликолиза и стимуляции глюконеогенеза .
Когда концентрация глюкозы растёт, повышается и уровень фруктозо-6-фосфата . Фруктозо-6-фосфат стимулирует фосфопротеинфосфатазу-1 , которая дефосфорилирует фосфофруктокиназу-2. В результате происходит активация её киназного домена, который катализирует образование Фр-2,6-Ф . Происходит стимуляция гликолиза и подавление глюконеогенеза.
Аллостерическая регуляция ФФК-2/ФБФ-2 схожа с таковой у ФФК-1 . Высокий уровень АМФ или неорганического фосфата означает, что в клетке не хватает энергии: такие условия стимулируют ФФК-2. С другой стороны, высокая концентрация фосфоенолпирувата (ФЕП) и цитрата означает, что в клетке много предшественников для биосинтеза АТФ, что ингибирует ФФК-2. В отличие от ФФК-1, активность ФФК-2 не зависит от концентрации АТФ.
Глюкагон подавляет киназную активность фермента, активируя протеинкиназу А, которая фосфорилирует фермент снижая киназную и стимулируя фосфатазную активность; через протеинкиназу А и ФФК-2/ФБФ-2 глюкагон снижает уровень фруктозо-2,6-бисфостфата, что приводит к подавлению гликолиза. Инсулин активирует обратный процесс, активируя протеинфосфатазу, которая дефосфорилирует ФФК-2/ФБФ-2, снижая её фосфатазную и усиливая киназную активность; в результате растёт концентрация фруктозо-2,6-бисфостфата, что активирует гликолиз.
На сегодняшний день у млекопитающих обнаружено пять изоферментов , часть из них образуется в результате транскрипции отдельных генов, а часть — в результате альтернативного сплайсинга . Все изоэнзимы радикально отличаются по своей регуляции: способ регуляции, описанный выше описан для самой изученной печёночной изоформы .
К генам человека, кодирующим белки с активностью фосфофруктокиназы-2 относятся:
Было показано, что у европейцев мутации в гене Pfkfb2 , кодирующем белок ФФК-2/ФБФ-2, связаны с предрасположенностью к шизофрении . Более того, было обнаружено, что регуляция активности ФФК-2 связана с работой сердца и механизмом, не допускающим развития гипоксии .