Бифуркация
- 1 year ago
- 0
- 0

Бифурка́ция электро́нов ( англ. electron bifurcation ) — это механизм разделения электронов в окислительно-восстановительной реакции : пара электронов соединения- донора разделяется на два отдельных электрона, которые переносятся на два одноэлектронных акцептора , при этом один электрон переносится на акцептор с более низким электрохимическим потенциалом за счёт энергии другого электрона, который переносится на акцептор с более высоким потенциалом, чем у исходного соединения.

Таким образом бифуркация электронов является механизмом сопряжения термодинамически невыгодной ( эндергонической ) реакции переноса одного электрона на акцептор с низким потенциалом за счёт энергии термодинамически выгодной ( экзергонической ) реакции переноса второго электрона, приводящего к минимизации потерь свободной энергии в результирующей реакции. Поэтому протекание суммарной реакции термодинамически оправданно и происходит спонтанно.
Обратный процесс — конфурка́ция электронов: при этом два одноэлектронных донора выступают вместе для восстановления акцептора получающейся парой электронов.
Существуют два типа бифуркации электронов: хинон- и флавинзависимая бифуркация электронов.
Ранние исследователи митохондрий не могли поверить своим глазам, когда они наблюдали процесс восстановления низкопотенциального цитохрома b митохондрий при добавлении сильного окислителя ( феррицианида ). Мысль о существовании хинон -зависимая бифуркация электронов (ХЗБЭ, англ. quinone based electron bifurcation (QBEB) ) была высказана свыше 40 лет назад Питером Митчеллом как о ключевом событии Q-цикла при работе комплекса bc1 дыхательной цепи , служащем для двукратного увеличения эффективности процесса переноса протонов через мембрану.
Комплекс bc1 использует убихинон (Е 0 '=+90 мВ) в качестве донора пары электронов. Высокопотенциальным одноэлектронным акцептором служит Риске — цитохром c (Е 0 '=+285 мВ). Вторым низкопотенциальным одноэлектронным акцептором служит цитохром b L (Е 0 '=-90 мВ) . Восстановленный цитохром b используется исключительно для генерации протонного градиента (ΔµН + ). Мембранные комплексы с похожей структурой и функцией встречаются во всех трёх доменах жизни. Бифуркация электронов в системах с уби-, пласто- и менахинонами встречается в митохондриях ( цитохром-bc1-комплекс#Q-цикл ), хлоропластах ( Цитохром-b6f-комплекс#Q-цикл ), в фотосинтетической и в дыхательной цепях переноса электронов бактерий.
Флавин-зависимая бифуркация электронов (сокр. ФЗБЭ, англ. flavin based electron bifurcation (FBEB) ) была открыта в 2008 году у клостридий . Wolfgang Buckel и Rudolf K. Thauer открыли, что обеспечивает требующий затрат энергии поток электронов от NADH (E 0 ‘=-320 мВ) к ферредоксину (E 0 ‘=-500 мВ) за счёт экзергонической реакции одновременного восстановления кротонил-КоА (E 0 ‘=-10 мВ) до бутирил-КоА. Фермент бутирил-КоА дегидрогеназа организована в комплекс с электрон-транспортным флавопротеином (англ. electron-transfer flavoprotein (Ets)). Флавин активного центра этого белка служит местом разделения пары электронов на два отдельных электрона, каждый из которых направляется к своему акцептору, с разными окислительно-восстановительными потенциалами. Позже ФЗБЭ была обнаружена во многих других строго анаэробных бактериях и археях , особенно в , ацетогенах и метаногенах .
По сути, сопряжение таких реакций аналогично субстратному фосфорилированию , при котором термодинамически невыгодные реакции сопряжены с гидролизом АТФ , идущим с выделением энергии, но идущее при гораздо меньших перепадах энергии и отличающееся по механизму. Никакого переноса фосфатной группы не происходит.
В 1857 году Луи Пастер опубликовал первое из своих многочисленных трудов о процессах брожения , которые он описал как «жизнь без воздуха» . Хотя эта работа по физиологии анаэробных микроорганизмов открыла новый век в микробиологических исследованиях, в течение последующих 150 лет внимание исследователей было сфокусировано в основном на метаболизме и физиологии аэробов. Соответственно неполное понимание механизмов анаэробного запасания энергии привело к идее, что анаэробные организмы запасают энергию неэффективно (например, они производят меньше АТФ, чем должно было получаться на основе термодинамических расчётов), но эта концепция противоречила большому выходу биомассы . За последние 10 лет ФЗБЭ изменила точку зрения на то, как анаэробные микроорганизмы запасают энергию . Долгое время считалось, что анаэробы неэффективно конвертируют энергию, потому что они способны её запасать только путём , но не за счёт хемиоосмотических механизмов на мембране клеток . При помощи сопряжения окислительно-восстановительных реакций по механизму ФЗБЭ анаэробные бактерии получают сильный восстановитель (ферредоксины, Е=-500 мВ) из веществ с более высоким электрохимическим потенциалом (например, водорода Е°’=-414 мВ или NADH E°’=-320 мВ) для последующего использования в труднопротекающих реакциях (восстановление углекислого газа при метаногенезе или восстановление атмосферного азота при азотфиксации , образование водорода во время брожения при его высоком парциальном давлении в окружающей среде). При окислении ферредоксина мембранными комплексами (Rnf) или (Ech), анаэробы могут генерировать мембранный потенциал, который может быть использован для синтеза АТФ. Этот механизм позволяет анаэробным бактериям извлекать энергию из окружающей среды полнее, что является ключевым для их выживания. Эти реакции особенно важны для анаэробных бактерий, живущих в восстановительной среде, где для запасания энергии трудно найти подходящую окислительно-восстановительную пару веществ, которая обеспечила бы при реакции друг с другом необходимуе величину энергии реакции для запасания её в виде АТР или в виде протонного или натриевого электрохимического градиента на мембране .
Таким образом, с помощью флавинсодержащих ферментов анаэробные организмы, не имеющие дыхательной цепи и, соответственно, ни менахинонов , ни цитохромов , могут осуществлять фосфорилирование на своих мембранах. Таким образом флавин-зависимая бифуркация электронов не является новым механизмом запасания энергии, но является новым механизмом для генерации «богатых энергией» восстановленных ферредоксина или флаводоксина.
Флавин-зависимая конфуркация электронов объясняет способность синтрофных бактерий потреблять их субстраты с выделением молекулярного водорода в условиях, которые термодинамически невыгодны без механизма сопряжения невыгодной реакции с выгодной .
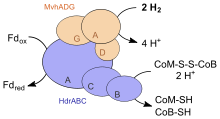
Комплексы с флавин-зависимой бифуркации электронов вовлечены в различные процессы, такие как маслянокислое брожение , метаногенез , ацетогенез , анаэробное окисление молочной кислоты , диссимиляторное восстановление сульфата , анаэробное деароматизирование, фиксацию азота, фиксацию углерода . Флавин-зависимая бифуркация электронов встречается там, где восстановительный потенциал реакции имеет порядок −400 мВ (среднее арифметическое между двумы окислительно-восстановительными потенциалами реакций (Е1-Е2)/2), более отрицательный, чем при хинон-зависимой бифуркации электронов . Донорами электронной пары могут являться НАД(Ф)Н (E°’=-320 мВ), метилентетрагидрофолат (Е°’=-200 мВ), F 420 H 2 , формиат, или молекулярный водород Н 2 . Высокопотенциальным конечным одноэлектронным акцептором являются НАД + , кротонил-КоА (E°’=-10 мВ), пируват (E°’=-190 мВ), гетеродисульфид (CoM-S-S-CoB)(E°’=-140 мВ) в метаногенах, менахинон или убихинон (E°’+90 мВ) . «Богатый энергией» низко-потенциальный конечный акцептор всегда является ферредоксин или флаводоксин, выполняет в отличие от цитохрома b L , в хинон-зависимой бифуркации электронов, двойную функцию. Он обеспечивает, при окислении, возникновение ΔµН + /Na + посредством ферментов: ферредоксин: НАД редуктазы (Rnf) или ферредоксин: протон редуктазы (Ech) , работающих как , или обеспечивает протекание трудных восстановительных реакций, таких как восстановление СО 2 до СО или формильной группы, протонов до газообразного водорода, азота до аммония, карбоксилирования ацетил-КоА до 2-оксокислот и активацию 2-гидроксиацил-КоА дегидратазы .
Механистическая основа этого нового важного сопрягающего механизма ещё далека от понимания.
Комплексы, осуществляющие флавин-зависимую бифуркацию электронов, обычно находятся в цитоплазме в растворенном виде и встречаются только у строго анаэробных бактерий и архей. Все комплексы можно разделить на 4 группы неродственных семейств:
Предполагается, что механизм бифуркации электронов использовался на ранних стадиях эволюции . При сравнении кристаллических структур и механизма транспорта электронов в электрон-переносящих флавопротеинах EtfAB и НАДН-зависимой ферредоксин: НАДФ редуктазой с комплексом III дыхательной цепи ( комплекса bc1 ) неожиданно обнаружено их несомненное сходство. НАД(Ф)Н дегидрогеназы (NuoF гомологи) имеют большое сходство с комплексом I дыхательной цепи ( НАДН-дегидрогеназный комплекс#Эволюционное происхождение ).