Interested Article - ETF-дегидрогеназа
- 2021-02-21
- 1
ETF-дегидрогеназа или (электронпереносящий флавопротеин)-дегидрогеназа (сокр. от англ. electron transfer flavoprotein-ubiquinone dehydrogenase ) — фермент, который переносит электроны с электронпереносящего флавопротеина (ETF), растворённого в матриксе митохондрий, на мембранный переносчик электронов — убихинон . Этот фермент есть как у прокариот , так и эукариот . У этого энзима есть две простетические группы : флавин и железосерный кластер . Нехватка ETF-дегидрогеназы у человека вызывает наследственное заболевание . Кроме того, этот фермент — третья точка поступления электронов в ЭТЦ .
Функция
У млекопитающих этот фермент важен в β-окислении жирных кислот , катаболизме аминокислот и холина . Он связывает β-окислении жирных кислот и прочие процессы с окислительным фосфорилирование. Множество ацетил-СоА - дегидрогеназ осуществляют окисление разных субстратов (например жирных кислот), перенося электроны на электронперносящий флавопротеин (ETF). ETF-дегидрогеназа в свою очередь окисляет этот белок и переносит электроны на растворённый во внутренней мембране митохондрий убихинон , восстанавливая его до убихинола , который затем поступает в дыхательную цепь переноса электронов.
→ Ацил-КоА-дегидрогеназа → ETF → ETF-дегидрогеназа → Q → Комплекс III
У растений ETF-Q-дегидрогеназа важна для выживания во время стресса и длительного периода темноты .
Реакция
ETF-дегидрогеназа катализирует следующую реакцию :
- ETF восстановленный + Q → ETF окисленный + QH 2 .
Механизм
Точный механизм восстановления убихинона неизвестен, но существуют две гипотезы. Согласно первой гипотезе электроны по одному передаются с ETF на низкопотенциальный ФАД . В результате в восстановленном состоянии один электрон остаётся на ФАД, а другой на железном центре. После этого восстанавливается убихинон, с переходом через стадию семихинона . Согласно второй гипотезе ETF передаёт электроны на железосерный центр, после чего происходит быстрый переброс между двумя центром и ФАД. После наступления равновесия, всё остальное происходит по вышеописанной схеме.
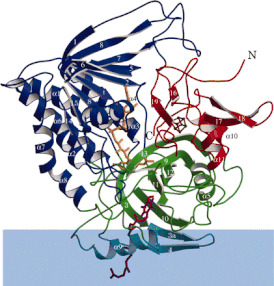
Структура фермента
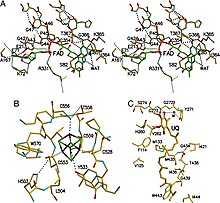
ETF-дегидрогеназа состоит из одного структурного домена и трёх близкорасположенных функциональных доменов: ФАД-связыввающий домен, 4Fe4S-связывающий домен и убихинон-связывающий домен . ФАД глубоко погружён в белковую часть своего домена. Множество водородных связей и положительный конец диполя из α-спирали оказывают влияние на редокс-потенциал ФАД и, возможно, стабилизируют семихинон -радикал. Железосерный кластер 4Fe-4S также стабилизирован обширными водородными связями вокруг самого кластера и его цистеинов . Связывание убихинона происходит в глубоком гидрофобном кармане, который у этого фермента отличается от других убихинон-связывающих белков, таких как сукцинатдегидрогеназа . В отличие от других убихинон-связывающих ферментов, этот фермент прикрепляется к поверхности мембраны и не пересекает липидный бислой .
В медицине
Недостаток ETF-дегидрогеназы приводит к развитию (также известной как множественная ацил-КоА-дегидрогеназная недостаточность), которая характеризуется нарушением распада жирных кислот и аминокислот . Болезнь может вызывать ацидоз или гипогликимию . К другим симптомам относится общая слабость, увеличенная печень, сердечная недостаточность и пониженное содержание левокарнитина . В более тяжёлых случаях могут наблюдаться врожденные пороки и полный метаболитический кризис . С точки зрения генетики — это аутосомное рецессивное наследственное заболевание. По этой причине оно встречается довольно редко. У большинства пациентов выявлена однонуклеотидная замена в месте взаимодействия ФАД и убихинона Более лёгкие формы этого расстройства поддаются лечению рибофлавиновой терапией, однако, из-за разнообразия мутаций, приводящих к развитию заболевания, симптоматика и соответствующее лечение могут сильно разниться .
См. также
Примечания
- . Дата обращения: 30 декабря 2015. 9 февраля 2016 года.
- Ghisla S., Thorpe C. Acyl-CoA dehydrogenases. A mechanistic overview (англ.) // : journal. — 2004. — February ( vol. 271 , no. 3 ). — P. 494—508 . — doi : . — .
- He M., Rutledge S.L., Kelly D.R., Palmer C.A., Murdoch G., Majumder N., Nicholls R.D., Pei Z., Watkins P.A., Vockley J. A new genetic disorder in mitochondrial fatty acid beta-oxidation: ACAD9 deficiency (англ.) // : journal. — 2007. — July ( vol. 81 , no. 1 ). — P. 87—103 . — doi : . — . — PMC .
- Watmough N.J., Frerman F.E. The electron transfer flavoprotein: ubiquinone oxidoreductases (англ.) // : journal. — 2010. — December ( vol. 1797 , no. 12 ). — P. 1910—1916 . — doi : . — .
- Vianey-Liaud C., Divry P., Gregersen N., Mathieu M. The inborn errors of mitochondrial fatty acid oxidation (англ.) // : journal. — 1987. — Vol. 10 Suppl 1 . — P. 159—200 . — doi : . — .
- Ikeda Y. , Dabrowski C. , Tanaka K. (англ.) // The Journal of biological chemistry. — 1983. — Vol. 258, no. 2 . — P. 1066—1076. — .
- Ruzicka F. J. , Beinert H. (англ.) // The Journal of biological chemistry. — 1977. — Vol. 252, no. 23 . — P. 8440—8445. — .
- Ishizaki K. , Larson T. R. , Schauer N. , Fernie A. R. , Graham I. A. , Leaver C. J. (англ.) // The Plant cell. — 2005. — Vol. 17, no. 9 . — P. 2587—2600. — doi : . — .
- Ramsay R.R., Steenkamp D.J., Husain M. Reactions of electron-transfer flavoprotein and electron-transfer flavoprotein: ubiquinone oxidoreductase (англ.) // : journal. — 1987. — February ( vol. 241 , no. 3 ). — P. 883—892 . — . — PMC .
- Zhang J., Frerman F.E., Kim J.J. Structure of electron transfer flavoprotein-ubiquinone oxidoreductase and electron transfer to the mitochondrial ubiquinone pool (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — October ( vol. 103 , no. 44 ). — P. 16212—16217 . — doi : . — . — PMC .
- Zhang J. , Frerman F. E. , Kim J. J. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2006. — Vol. 103, no. 44 . — P. 16212—16217. — doi : . — .
- Frerman F. E. Goodman S. I. Deficiency of Electron Transfer Flavoprotein or Electron Transfer Flavoprotein:Ubiquinone Oxidoreductase in Glutaric Acidemia Type II Fibroblasts (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1985. — Vol. 82 , no. 13 . — P. 4517—4520 . — doi : .
- Galloway J.H., Cartwright I.J., Bennett M.J. Abnormal myocardial lipid composition in an infant with type II glutaric aciduria (англ.) // : journal. — 1987. — March ( vol. 28 , no. 3 ). — P. 279—284 . — .
- Singla M., Guzman G., Griffin A.J., Bharati S. (англ.) // Pediatric Cardiology : journal. — 2008. — March ( vol. 29 , no. 2 ). — P. 446—451 . — doi : . — .
- Turnbull D.M., Bartlett K., Eyre J.A., Gardner-Medwin D., Johnson M.A., Fisher J., Watmough N.J. Lipid storage myopathy due to glutaric aciduria type II: treatment of a potentially fatal myopathy (англ.) // : journal. — 1988. — October ( vol. 30 , no. 5 ). — P. 667—672 . — doi : . — .
- Liang W.C., Ohkuma A., Hayashi Y.K., López L.C., Hirano M., Nonaka I., Noguchi S., Chen L.H., Jong Y.J., Nishino I. ETFDH mutations, CoQ10 levels, and respiratory chain activities in patients with riboflavin-responsive multiple acyl-CoA dehydrogenase deficiency (англ.) // : journal. — 2009. — March ( vol. 19 , no. 3 ). — P. 212—216 . — doi : . — .
- Goodman S.I., Binard R.J., Woontner M.R., Frerman F.E. Glutaric acidemia type II: gene structure and mutations of the electron transfer flavoprotein:ubiquinone oxidoreductase (ETF:QO) gene (англ.) // : journal. — 2002. — Vol. 77 , no. 1—2 . — P. 86—90 . — doi : . — .
- Olsen R.K., Olpin S.E., Andresen B.S., Miedzybrodzka Z.H., Pourfarzam M., Merinero B., Frerman F.E., Beresford M.W., Dean J.C., Cornelius N., Andersen O., Oldfors A., Holme E., Gregersen N., Turnbull D.M., Morris A.A. ETFDH mutations as a major cause of riboflavin-responsive multiple acyl-CoA dehydrogenation deficiency (англ.) // : journal. — Oxford University Press , 2007. — August ( vol. 130 , no. Pt 8 ). — P. 2045—2054 . — doi : . — .
- Rhead W., Roettger V., Marshall T., Amendt B. Multiple acyl-coenzyme A dehydrogenation disorder responsive to riboflavin: substrate oxidation, flavin metabolism, and flavoenzyme activities in fibroblasts (англ.) // : journal. — 1993. — February ( vol. 33 , no. 2 ). — P. 129—135 . — doi : . — .
Внешние ссылки
- от 16 мая 2011 на Wayback Machine
- OMIM
- 2021-02-21
- 1