Риманова поверхность
- 1 year ago
- 0
- 0
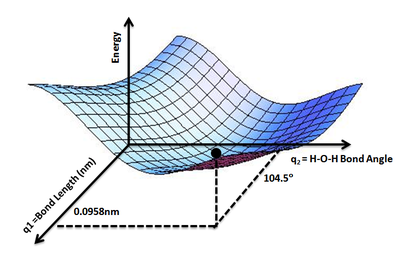
Поверхность потенциальной энергии применяется для описания энергии системы, в особенности множества атомов, в терминах определённых параметров, обычно — координат атомов. Поверхность может определять энергию как функцию одной или нескольких координат. Если координата только одна, то поверхность называется кривой потенциальной энергии или профилем энергии.
В некоторых случаях полезно использовать аналогию с ландшафтом: если у системы две степени свободы, то значение энергии можно представить как высоту в зависимости от двух координат.
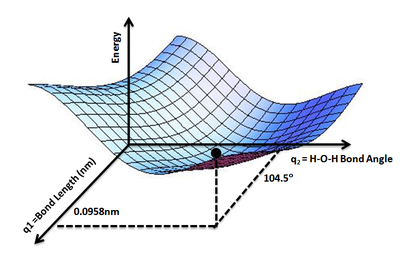
Понятие поверхности потенциальной энергии применяется в физике и химии, особенно в теоретических разделах этих дисциплин, и может использоваться для теоретического исследования свойств структур атомов, например, для определения формы с минимальной энергией для молекулы или для вычисления скорости химических реакций.
Геометрия набора атомов может быть описана вектором r , элементы которого показывают расположение атомов. Вектор r может быть множеством декартовых координат атомов или же набором межатомных расстояний и углов.
При известном r энергия является функцией E ( r ) для всех рассматриваемых значений r . Пользуясь аналогией с ландшафтом, можно рассматривать величину E как высоту "ландшафта энергии", то есть как меру высоты поверхности потенциальной энергии.
Для изучения химических реакций с помощью поверхности потенциальной энергии как функции положения атомов необходимо вычислять энергию для каждого рассматриваемого взаимного расположения частиц. Методы расчёта энергии для конкретного относительного расположения частиц описаны в статьях по вычислительной химии , особое внимание уделяется нахождению приближённого значения энергии E ( r ) для получения информации о энергии и положении частиц с высоким разрешением.
Для очень простых химических систем или при введении упрощающих предположений о взаимодействии атомов иногда возможно использовать аналитические выражения для энергии в виде функции расположения атомов. Примером является потенциал Лондона-Эйринга-Полани-Сато для системы H + H 2 в виде функции трёх расстояний H-H.
Для более сложных систем вычисление энергии определённого расположения атомов зачастую представляет собой слишком сложную вычислительную задачу, поэтому получить точки поверхности с высоким разрешением сложно. Для таких систем возможным подходом является вычисление только уменьшенного количества точек на поверхности и затем применение метода интерполяции, например .
Поверхность потенциальной энергии является удобным инструментом для исследования молекулярной геометрии и динамики химических реакций. На поверхности вычисляются только необходимые точки. В целом точки классифицируют по значениям первой и второй производной энергии по координатам, то есть по величине градиента и кривизны. Стационарные точки (с нулевым градиентом) имеют физический смысл: минимум энергии соответствует физически устойчивым образцам, а седловые точки соответствуют переходным состояниям, точка с наибольшей высотой является координатой реакции.
Поверхности потенциальной энергии для химических реакций можно классифицировать как поверхности притяжения и отталкивания по сравнению величины длины химических связей. Для реакции типа A + B—C → A—B + C, увеличение длины химической связи A—B определяется как R* AB = R AB − R 0 AB , где R AB является длиной химической связи A—B в переходном состоянии, а R 0 AB в молекуле продукта реакции. Аналогично для связи, разрушающейся при реакции, R* BC = R BC − R 0 BC , где R 0 BC относится к молекуле реагента.
Для экзотермических реакций поверхность потенциальной энергии при R* AB > R* BC такова, что переходное состояние достигается при приближении реактантов друг к другу. После переходного состояния длина химической связи A—B продолжает уменьшаться, при этом большая часть выделяющейся энергии преобразуется в энергию колебаний. Примером является гарпунный механизм K + Br 2 → K—Br + Br. Молекулы продукта реакции, переведённые под воздействием колебаний в возбуждённое состояние, могут быть обнаружены по инфракрасной хемолюминесценции .
Поверхность потенциальной энергии для реакции H + Cl 2 → HCl + Cl такова, что R* HCl < R* ClCl и состояние перехода достигается, когда продукты реакции разделяются. Для реакции, в которой атом A (в данном случае H) легче, чем B и C, энергия реакции выделяется в основном в виде кинетической энергии продуктов реакции. Для реакции типа F + H 2 → HF + H, где атом A тяжелее чем B и C, происходит смешанное выделение энергии, как колебательной, так и энергии перемещения.
В эндотермических реакциях тип поверхности определяет тип энергии, который наиболее эффективен в ходе реакции.
Понятие поверхности потенциальной энергии для химических реакций впервые было предложено французским физиком Рене Марселеном в 1913 году. Первое полуэмпирическое вычисление поверхности потенциальной энергии было представлено для реакции H + H 2 Генри Эйрингом и Майклом Полани в 1931 году. Эйринг использовал поверхности потенциальной энергии для вычисления постоянных скорости реакции в теории переходных состояний в 1935 году.