Реакция Вассермана
- 1 year ago
- 0
- 0
Кардиолипин — фосфолипид , который является важным компонентом внутренней мембраны митохондрий , липидный состав которой включает около 20 % кардиолипина . Кардиолипин во внутренней мембране митохондрий клеток млекопитающих и растительных клеток необходим для функционирования многочисленных ферментов, участвующих в энергетическом обмене. Кардиолипин также встречается в мембранах бактерий.
Происхождение названия «кардиолипин» связано с открытием этого соединения: впервые кардиолипин был выделен из мышечной ткани сердца быка в начале 1940-х годов.
В зарубежной биохимической литературе для кардиолипина используют сокращение «CL».
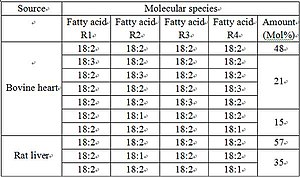
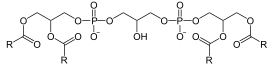
Кардиолипин представляет собой дифосфатидилглицерол: два фосфатидилглицерола соединены с глицеролом , формируя димерную структуру. Таким образом, кардиолипин имеет четыре хвоста жирных кислот и два остатка ортофосфорной кислоты . Четыре алкильных группы кардиолипина открывают широкие возможности для разнообразия. Однако в большинстве животных тканей кардиолипин содержит C 18 -цепи с двумя ненасыщенными связями в каждой из них. Возможно, (18:2)-4 конфигурация радикальных групп является важным структурным требованием для высокой аффинности кардиолипина к белкам внутренней мембраны митохондрий млекопитающих , хотя, согласно некоторым исследованиям, важность этой конфигурации зависит от рассматриваемого белка.
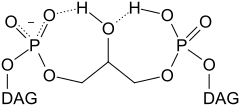
Каждый из фосфатов кардиолипина может связать один протон. При этом ионизация одного фосфата происходит при значении pH , сильно отличном от кислотности среды, при которой ионизуются обе фосфатные группы: pK 1 = 3, pK 2 > 7.5. Поэтому при нормальных физиологических условиях (значение pH примерно равно 7) кардиолипин несёт только один отрицательный элементарный заряд. Гидроксильные группы (-OH and -O - ) фосфатов образуют при этом внутримолекулярные водородные связи с центральной гидроксильной группой глицерола, формируя бициклическую резонансную структуру . Эта структура связывает один протон, который затем используется при окислительном фосфорилировании . Такая бициклическая структура «головки» кардиолипина очень компактна, и «головка» этого фосфолипида мала относительно большого «хвоста» , состоящего из четырёх длинных цепей.

Кардиолипин образуется из (PG), который в свою очередь синтезируется из (CDP-DAG ) и (G3P) .
У дрожжей, растений и животных процесс синтеза кардиолипина, как считается, протекает в митохондриях. Первый этап — ацилирование глицерол-3-фосфата(G3P) ферментом глицерол-3-фосфат ацилтрансферазой(AGP-AT). Затем ацилглицерол-3-фосфат может быть повторно ацилирован этим же ферментом с образованием фосфатидной кислоты. Фермент CDP-DAG синтаза (фосфатидат цитидилтрансфераза) участвует в последующем превращении фосфатидной кислоты в цитидиндифосфат-диацилглицерол (CDP-DAG). Следующий этап процесса — присоединение G3P к CDP-DAG и превращение в фосфатидилглицеролфосфат (PGP) с участием фермента PGP синтазы(PGPS). Затем происходит дефосфорилирование (с помощью PTPMT1 ) с образованием фосфатидилглицерола (PG). На последней стадии синтеза еще одна молекула CDP-DAG используется для связывания с PG, в результате чего и образуется молекула кардиолипина. Эта реакция катализируется ферментом кардиолипин синтазой (CLS), локализованной в митохондриях ..
В бактериях дифосфатидилглицерол синтаза катализирует перенос фосфатидной группы одного фосфатидилглицерола на свободную 3’-гидроксильную группу другого. В некоторых физиологических условиях реакция может происходить в обратном направлении, в таком случае происходит расщепление кардиолипина.
Благодаря особенной бициклической структуре кардиолипина изменение pH и присутствие бивалентных катионов могут способствовать изменениям в его структуре. Для кардиолипина свойственно большое разнообразие различных форм образуемых им полимеров. Установлено, что наличие в присутствии Ca 2+ или других бивалентных катионов у кардиолипина возможен переход из ламеллярной фазы в гексагональную (переход L a -H II ) . Считается, что этот переход имеет непосредственную связь с процессом слияния мембран .
Фермент цитохромоксидаза (комплекс IV дыхательной цепи ) — большой трансмембранный белковый комплекс, обнаруженный в бактериях и митохондриях. Это последний из ферментов в цепи переноса электронов , расположенный в митохондриальной (бактериальной мембране). Комплекс IV катализирует перенос 4 электронов с 4 молекул цитохрома c на O 2 , в результате чего образуется две молекулы воды. Было показано, что для поддержания ферментативной активности комплекса IV необходимы 2 связанные с ним молекулы кардиолипина.
Для поддержания четвертичной структуры и функциональной активности цитохром-bc 1 -комплекса (комплекса III) также необходим кардиолипин. АТФ-синтаза (комплекс V) также демонстрирует высокую аффинность к кардиолипину, связывая кардиолипин в соотношении 4 молекулы кардиолипина на одну молекулу комплекса V.
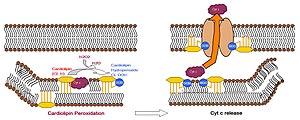
Кардиолипин-специфичная оксигеназа катализирует образование гидроперекиси кардиолипина, что приводит к конформационным изменениям последнего. Осуществляющееся в результате этого перемещение кардиолипина на внешнюю мембрану митохондрии способствует образованию поры, через которую может выходить цитохром c . Выход цитохрома c из в цитозоль индуцирует процесс апоптоза .
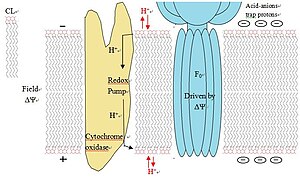
В процессе окислительного фосфорилирования происходит перемещение протонов из матрикса митохондрии в межмембранное пространство, что обуславливает разницу в pH. Предполагается, что кардиолипин функционирует как протонная ловушка в митохондриальных мембранах, локализуя этот поток протонов и минимизируя тем самым изменения pH в межмебранном пространстве.
Эта функция объясняется особенностями структуры кардиолипина: захватывая протон, кардиолипин образует бициклическую структуру, которая несёт отрицательный заряд. Таким образом бициклическая структура может освобождать или связывать протоны для поддержания pH.
Окислительный стресс и перекисное окисление липидов способствуют развитию потери нейронов и митохондриальной дисфункции в чёрной субстанции при развитии болезни Паркинсона , а также могут играть роль в патогенезе болезни Альцгеймера . Как установлено, содержание кардиолипина в мозге уменьшается по мере старения , а последние исследования на мозге крысы показывают, что причиной этого является перекисное окисление липидов в митохондриях, подверженный окислительному стрессу. Согласно другому исследованию, биосинтез кардиолипина может быть ослаблен, приводя к восстановлению 20 % кардиолипина. Наблюдается также связь с 15 % уменьшением функции комплексов I/III электрон-транспортной цепи, что считается ключевым фактором в развитии болезни Паркинсона.
Более 60 миллионов человек по всему миру заражены вирусом иммунодефицита человека . Гликопротеин вируса ВИЧ-1 (HIV-1) имеет по меньшей мере 4 сайта для нейтрализующих антител. Среди них мембранно-проксимальный участок особенно «привлекателен» как мишень для антител, так как он облегчает вход вируса в T-клетки и высоко консервативен в разных штаммах. Однако обнаружено, что 2 антитела 2F5 и 4E10 в мембранно-проксимальном участке взаимодействуют с собственными антигенами (эпитопами), в том числе с кардиолипином. Таким образом, затруднительно использовать такие антитела при вакцинации.
У людей, больных диабетом , сердечные приступы случаются в два раза чаще, чем у людей, не страдающих этим заболеванием. У диабетиков сердечно-сосудистая система поражается на раннем этапе заболевания, что часто заканчивается преждевременной смертью, делая сердечные заболевания основной причиной смерти людей, болеющих диабетом. Кардиолипин на ранних стадиях диабета находится в сердечной мышце в недостаточных количествах, что может быть вызвано липидо-разрушающим ферментом, который становится более активным при диабете .
Отто Генрих Варбург впервые предложил, что происхождение рака связано с необратимым повреждением клеточного дыхания в митохондриях, однако структурная основа такого повреждения оставалась неясной. Так как кардиолипин является важным фосфолипидом внутренней мембраны митохондрии и необходим для осуществления функции митохондрии, была предложена идея, что именно аномалии в структуре кардиолипина могут негативно сказываться на функции митохондрий и биоэнергетике. Недавнее исследование , которое проводилось на опухолях мозга мышей, показало, что основные аномалии во всех опухолях связаны именно со структурой кардиолипина или его содержанием.
В 2008 году доктор Кулик (Dr. Kulik) обнаружил, что все исследованные пациенты с Синдромом Барта имели нарушения в молекулах кардиолипина. Синдром Барта — редкое генетическое заболевание, которое, как было установлено в 1970-е годы, может приводить к смерти в младенческом возрасте. Этот синдром обусловлен мутациями в гене TAZ, кодирующем — фермент (фосфолипид-лизофосфолипид трансацилазу), участвующий в биосинтезе кардиолипина. Этот фермент катализирует перенос линолевой кислоты с фосфатидилхолина на монолизокардиолипин и является необходимым для синтеза кардиолипина у эукариот. Одним из результатов мутаций является неспособность митохондрий поддерживать необходимое производство АТФ . Ген тафазина у человека расположен в длинном плече X хромосомы (Xq28) , поэтому женщины- гетерозиготы не повержены синдрому Барта .
Кардиолипин из сердца коров используется в качестве антигена в тесте Вассермана на сифилис. Антикардиолипиновые антитела могут быть использованы для диагностики других болезней, в том числе малярии и туберкулёза.