Interested Article - Мимивирус
- 2020-01-13
- 1
Мимивирус ( лат. Mimivirus ) — род вирусов , включающий в себя единственный вид Acanthamoeba polyphaga mimivirus ( APMV ), хозяевами которого являются амёбы рода Acanthamoeba .
До октября 2011 года, когда был описан ещё более крупный Megavirus chilensis , считалось, что мимивирус обладает самым крупным капсидом среди всех известных вирусов — около 500 нм в диаметре . В отличие от большинства других вирусов, мимивирус не проходит через фильтр с диаметром пор 0,22 мкм и виден в световой микроскоп , по размерам он близок к небольшим бактериям, таким как микоплазма . Кроме того, по сравнению с другими вирусами и даже некоторыми бактериями , мимивирус обладает более объёмным (около 1,2 миллионов пар нуклеотидов ) и сложноструктурированным геномом .
В свете нехватки точных данных о природе данного вируса его открытие вызвало большой интерес в научных кругах. Один из первооткрывателей мимивируса высказал предположение, что он представляет собой недостающее звено между вирусами и клеточными организмами . Имеется и более радикальное мнение, согласно которому мимивирус представляет собой принципиально новую форму жизни , не относящуюся к вирусам или бактериям .
Этимология названия
Название «мимивирус» было дано этому вирусу как сокращение от «мимикрирующий под микроб» ( англ. mimicking microbe virus ). Это связано с тем, что некоторое время этот вирус считали микроорганизмом , а не вирусом, на основании таких признаков, как крупный размер, наличие белковых нитей, похожих на жгутики, и способность окрашиваться по методу Грама .
Открытие
APMV был впервые обнаружен в 1992 году в амёбе , в честь которой он и был назван, в ходе поисков возбудителей легионеллёза . Вирус был обнаружен в препарате, окрашенном по методу Грама, и вследствие этого ошибочно принят за грамположительную бактерию . Организм был назван Bradfordcoccus в честь района, в котором была найдена амёба ( Брадфорд , Англия ). После неудачных попыток культивирования и ПЦР -типирования этого организма с помощью универсальных праймеров, узнающих гены бактериальной 16S рРНК , образец пролежал в холодильнике 10 лет . Позднее он был передан во Францию, где были проведены дополнительные исследования, позволившие заключить, что Bradfordcoccus на самом деле является гигантским вирусом. Результаты работы были опубликованы в 2003 году в журнале « Science » .
Классификация
Род мимивирус принадлежит к семейству Mimiviridae . Это семейство относят к внесистематической группе крупных ядерно-цитоплазматических ДНК-содержащих вирусов ( англ. nucleocytoplasmic large DNA viruses, NCLDVs ), к которой также относятся поксвирусы , иридовирусы , , и . Все эти вирусы отличаются крупными размерами, схожими молекулярными характеристиками и сложными геномами . Ряд белков мимивируса, принимающих участие в репликации генома, оказались гомологичными белкам других крупных ядерно-цитоплазматических ДНК-содержащих вирусов, что говорит об их общем происхождении. Однако большое количество мимивирусных белков не обнаруживают сходства ни с одним известным в настоящее время белком. Кроме того, геном мимивируса кодирует значительное количество белков, напоминающих эукариотические и бактериальные . По-видимому, эти гены были приобретены мимивирусом вторично и происходят из геномов хозяев вируса и их паразитов .
Семейство Mimiviridae до сих пор не было отнесено Международным комитетом по таксономии вирусов (ICTV) к какому-либо отряду . В 2012 году было высказано предложение сгруппировать это и несколько других семейств крупных вирусов в новый отряд .
В научной литературе в последние годы можно встретить альтернативный термин, обозначающий группу гигантских вирусов — .
Согласно классификации вирусов по Балтимору мимивирус относится к группе I (вирусы, содержащие двуцепочечную ДНК и не имеющие обратной транскриптазы). В эту группу входят такие семейства вирусов, как иридовирусы, поксвирусы и другие.
Структура
Капсид и внешние оболочки


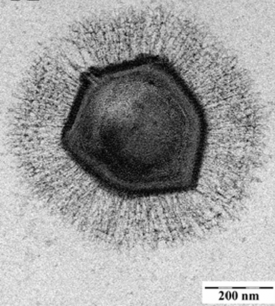
Мимивирус имеет примерно икосаэдрический капсид диаметром 400—500 нм . Капсид покрыт многочисленными белковыми нитями длиной 80—120 нм. В научной литературе приводятся размеры вириона от 400 до 800 нм, в зависимости от того, замеряется ли диаметр капсида или общая длина вируса вдоль продольной оси, включая белковые нити. Основной белок капсида мимивируса является продуктом гена L425 и состоит из двух доменов с укладкой типа jelly-roll («рулет»). Этот белок формирует гомотримерные капсомеры — единицы организации капсида. Капсомеры упакованы гексагонально в виде «ромашек»: шесть капсомеров окружают одно углубление между ними . Также в составе капсида обнаруживается структурный белок сердцевины L410 .
На одной из вершин капсида обнаружена звёздчатая структура, лучи которой разделяют пять треугольных граней, сходящихся в этой вершине. Лучи имеют ширину около 50 нм, толщину — 40 нм и длину — 200 нм, почти доходя до соседних вершин. Присутствие этой структуры изменяет взаимное расположение граней вириона, в результате чего его форма отклоняется от идеально икосаэдрической: через вирион можно провести только одну ось пятилучевой симметрии, которая проходит через вершину, отмеченную звёздчатой структурой. Так как на поверхности звёздчатой структуры не наблюдается гексагонально упорядоченных углублений, предполагают, что она состоит из белка, который отличается от основного белка капсида . Данная структура играет особую роль при заражении клетки-хозяина: при инфицировании звёздчатая «застёжка» открывается, и через это место ДНК вируса выходит из капсида. По этой причине звёздчатую структуру ещё называют «звёздными вратами» .
У мимивируса не наблюдается внешней оболочки, что указывает на то, что он покидает заражённую клетку не путём экзоцитоза .
Капсид мимивируса покрыт снаружи густым слоем длинных белковых нитей. Исследование этих нитей с помощью атомно-силового микроскопа показало, что они часто бывают присоединены к общей несущей структуре и заканчиваются небольшой глобулой. Однако до сих пор неизвестно, к каким участкам поверхности капсида они прикрепляются . Белковые нити устойчивы к воздействию протеаз до тех пор, пока их не обработать лизоцимом , это указывает на то, что эти нити покрыты пептидогликаном . Это хорошо согласуется с тем, что мимивирус окрашивается по методу Грама. Существует мнение, что сильно гликозилированная поверхность нитей может играть роль в привлечении амёб-хозяев .
Нуклеокапсид
Мимивирус обладает многими особенностями строения, характерными для других крупных ядерно-цитоплазматических ДНК-содержащих вирусов. Например, сразу под капсидом у мимивируса находятся два электронноплотных слоя, которые предположительно являются мембранами . Под этими мембранами находится белковая оболочка толщиной около 7 нм, внутри которой заключена линейная двухцепочечная ДНК вируса. Все описанные компоненты образуют так называемый нуклеокапсид. Стенки нуклеокапсида отстают от стенок капсида примерно на 30 нм, в районе звёздчатой структуры поверхность нуклеокапсида вдавлена . Предполагают, что пространство между вершиной звёздчатой структуры и нуклеокапсидом может быть заполнено гидролитическими ферментами , которые нужны для проникновения вируса в клетку. Между капсидом и нуклеокапсидом были обнаружены внутренние белковые нити, которые предположительно обеспечивают стабильное положение второго внутри первого .
Неструктурные белки и РНК
Помимо структурных белков капсида, в составе вириона обнаруживают и другие белки, которые классифицируют на несколько функциональных групп:
-
белки, участвующие в
транскрипции
,
- 5 субъединиц ДНК-зависимой РНК-полимеразы ,
- 2 хеликазы (R350, L540),
- кэпирующий фермент ,
- 4 фактора транскрипции (L377, L538, L544, R563),
- белки окислительных путей (предположительно помогают вирусу преодолеть окислительный стресс , связанный с активацией защитных систем клетки-хозяина) (9),
-
белки, модифицирующие
липиды
и белки,
- 2 протеинкиназы ,
- протеинфосфатаза,
- фосфоэстераза,
- липаза ,
-
белки, участвующие в метаболизме ДНК,
- топоизомеразы IA и IB,
- эндонуклеаза, корректирующая повреждения ДНК ультрафиолетовым светом .
Кроме белков и ДНК, из очищенных вирионов были выделены несколько различных мРНК , кодирующих ДНК-полимеразу (R322), главный белок капсида L425, TFII-подобный фактор транскрипции (R339), 3 аминоацил-тРНК-синтетазы (L124, L1164 и R663) и 4 неидентифицированных белка, специфичных для мимивируса. По-видимому, трансляция этих мРНК клеточным аппаратом биосинтеза белка необходима для начала репликации вируса. Другие ДНК-содержащие вирусы, такие как цитомегаловирус ( Cytomegalovirus ) и вирус простого герпеса ( Herpes simplex virus type-1 ), также содержат мРНК .
Геном
Общая структура
Геном мимивируса, состоящий из линейной молекулы двухцепочечной ДНК, был полностью секвенирован в 2004 году . Он содержит 1 181 404 пары оснований и является вторым крупнейшим известным геномом среди вирусов, уступая только Megavirus chilensis (по данным на 2012 год) . Кроме того, мимивирус обладает бо́льшим объёмом генетической информации, чем как минимум 30 организмов, имеющих клеточное строение .
По сведениям на 2010 год в геноме мимивируса насчитывают 986 открытых рамок считывания , 6 из которых кодируют тРНК . Такое количество белковых продуктов является очень большим для вируса — некоторые вирусы обходятся всего четырьмя минимально необходимыми белками . Детальные исследования генома всё ещё продолжаются: исправляются ошибки секвенирования, обнаруживаются новые рамки считывания .
Несмотря на большой размер генома, он используется довольно эффективно: на долю кодирующей ДНК приходится около 90,5 % всего объёма генома, это близко к тому, что наблюдается у других крупных ядерно-цитоплазматических ДНК-содержащих вирусов. Открытые рамки считывания разделены между собой промежутками примерно в 157 пар нуклеотидов. Две цепочки ДНК, названные R ( англ. right — правая ) и L ( англ. left — левая ), кодируют примерно одинаковое количество генов (450 и 465 соответственно, по данным на 2010 год). В геноме мимивируса не обнаруживается признаков деградации, характерных для геномов паразитических бактерий, таких как псевдогены и мобильные генетические элементы . Содержание адениновых и тимидиновых нуклеотидов довольно высоко — 72 %, что ведёт к повышенному содержанию в белках аминокислот , кодируемых АТ-богатыми кодонами (например, изолейцина , аспарагина и тирозина ). Вблизи концов молекулы ДНК были обнаружены инвертированные повторы длиной 617 пар нуклеотидов. Предполагают, что комплементарное взаимодействие этих участков может приводить к формированию Q-структуры — кольцевой ДНК с двумя небольшими хвостами .
Гены
Примерно для половины генов мимивируса не обнаружены гомологи в современных базах данных, и только для 24 % известна предполагаемая функция .
В геноме мимивируса были обнаружены гомологи практически всех ключевых генов, характерных для других крупных ядерно-цитоплазматических вирусов. В то же время данный геном содержит примерно вдвое больше генов, чем геномы родственных вирусов, причём среди этих генов много уникальных. Например, геном мимивируса кодирует несколько белковых компонентов аппарата трансляции: тирозил-, аргинил-, цистеил- и метионил- тРНК-синтетазы , гомологи факторов инициации трансляции (L496), (R458) и / (R464), фактора элонгации трансляции (R624) и фактора терминации трансляции (R726). Помимо генов белков, участвующих в трансляции, обнаружено 6 генов, которые предположительно кодируют тРНК, узнающие кодоны для лейцина , триптофана , гистидина и цистеина . Кроме того, мимивирус кодирует два гомолога РНК-урацил-5-метилтрансферазы (R405, R407) — фермента, метилирующего остаток урацила в тРНК и рРНК .
К другим необычным для вирусов генам относятся гены трёх типов топоизомераз и полного набора ферментов репарации , которые способны исправлять ошибки в ДНК, возникшие в результате действия окислителей, ультрафиолетового облучения и алкилирующих веществ. Также мимивирус кодирует ферменты углеводного, липидного и аминокислотного метаболизма .
Регуляция генома
Механизмы приспособления мимивируса к изменениям среды на протяжении многих поколений демонстрируют, наряду с признаками дарвинистической эволюции , признаки, соответствующие принципам ламаркизма . Так, например, у мимивируса в условиях пониженной конкуренции происходит репрессия некоторых генов. Это изменение наследуется следующими поколениями вируса, в некоторых случаях усиливаясь вплоть до полной инактивации этих генов. Предположительно, эффект является следствием худшей репарации менее используемых генов .
Другие особенности
Мимивирус является одним из немногих дцДНК-вирусов, в геноме которых обнаружена последовательность, кодирующая интеин . Интеин представляет собой белковый домен , который катализирует своё собственное вырезание из несущей молекулы и сшивание образовавшихся концов. Такая последовательность присутствует в гене ДНК-полимеразы B мимивируса .
Октамерная последовательность AAAATTGA была обнаружена примерно перед половиной генов мимивируса в положении от −80 до −50. Эта последовательность является TATA-подобным промоторным элементом и узнаётся транскрипционным аппаратом вируса на ранней стадии жизненного цикла . Другая вырожденная АТ-богатая последовательность является поздним промотором .
Жизненный цикл
Клетки-хозяева
Первым известным хозяином мимивируса является амёба Acanthamoeba polyphaga . Попытки экспериментально инфицировать клетки других одно- и многоклеточных организмов показали, что только другие представители рода Acanthamoeba — A. castellanii и A. mauritaniensis — могут служить хозяевами данного вируса . Некоторые данные указывают на то, что мимивирус может проникать в макрофаги человека и мышей и размножаться в них .
Цикл репликации

Мимивирус имеет 24-часовой литический (сопровождающийся лизисом клетки-хозяина) жизненный цикл с эклипс-фазой продолжительностью 4—5 часов . Все стадии жизненного цикла протекают в цитоплазме клетки .
Заражение амёбы мимивирусом предположительно происходит по следующему сценарию:
- Вирионы мимивируса, напоминающие бактерий своими размерами и присутствием характерных полисахаридов на поверхности, поглощаются амёбой как пища в процессе эндоцитоза ;
- Белковые нити частично лизируются в эндосомах , в результате чего капсид может взаимодействовать с эндосомальной мембраной;
- Капсид раскрывается в районе звёздчатой структуры, и его содержимое высвобождается в цитоплазму в результате слияния внутренней мембраны и мембраны эндосомы (это происходит примерно через 2 часа после инфицирования);
- После выхода коровой частицы (внутренней части нуклеокапсида) в цитоплазму, благодаря наличию в ней вирусного аппарата транскрипции, начинается синтез вирусных мРНК. Эти мРНК накапливаются внутри коровой частицы в виде гранул . Предполагают, что первыми под действием вирусной РНК-полимеразы транскрибируются гены, которые находятся под контролем AAAATTGA-промотора (см. раздел Геном);
- Через 4—5 часов после заражения вирусная ДНК выходит из коровой частицы и деконденсируется, начинается её репликация. В результате рядом с пустой оболочкой коровой частицы формируется так называемая «вирусная фабрика» — место синтеза компонентов и сборки вирусных частиц . Если в клетку проникли несколько вирусных частиц, то формируемые ими «фабрики» сливаются в одну по мере разрастания;
- Через 6—9 часов после заражения можно наблюдать процессы сборки капсидов и упаковки в них ДНК, которые происходят на периферии «вирусных фабрик». Необычным свойством мимивируса является то, что ДНК упаковывается и выходит из капсида через два разных отверстия ;
- Через 14—24 часа после инфекции происходит лизис клетки амёбы и высвобождение вирионов, к этому моменту их накапливается в клетке более 300 единиц .
Патогенность
Существует гипотеза , что мимивирус может вызывать у людей некоторые формы пневмонии . До сих пор были найдены лишь косвенные свидетельства в пользу этой гипотезы. Во-первых, было показано, что в условиях эксперимента мимивирус способен заражать человеческие макрофаги , проникая в клетки в процессе фагоцитоза, и реплицироваться в них . Во-вторых, в нескольких исследованиях у небольшого количества пациентов, страдающих пневмонией, были обнаружены антитела против мимивируса . Также был описан единичный случай развития пневмонии у лаборанта, который работал с культурами этого вируса. Содержание антител против мимивируса в его крови тоже было повышенным . Тем не менее, присутствие антител против вируса само по себе не говорит о его патогенности, не исключено, что мимивирус просто обладает сильными иммуногенными свойствами .
С другой стороны, ни в одном из зарегистрированных случаев не удалось выделить вирус в чистом виде из образцов жидкостей, полученных от пациентов. Кроме того, исследования, в которых использовалась полимеразная цепная реакция , не обнаружили присутствия мимивируса у пациентов с пневмонией. В 2012 году группа Ванспоуна опубликовала результаты исследования больных пневмонией с целью определить роль мимивируса как возможного патогена. Ни у одного из 109 исследованных пациентов не был обнаружен мимивирус, и лишь у трёх были обнаружены антитела к нему . В целом, вопрос о патогенности мимивируса для человека остаётся открытым, но в качестве охранной меры предлагается рассматривать его как организм II группы патогенности .
Вирофаги мимивируса

Научная группа, открывшая мимивирус, также изолировала несколько других родственных ему вирусов, включая чуть более крупный ( англ. Mamavirus ). При изучении вирусных фабрик мамавируса было обнаружено, что на них также собираются небольшие вирионы другого вируса, который был назван Спутником ( англ. Sputnik ) . Спутник, по всей видимости, сам не способен заражать клетки амёб и размножаться в них, но может делать это совместно с мама- или мимивирусом, что классифицирует его как вирус-сателлит . Спутник стал первым известным вирусом-сателлитом, содержащим двухцепочечную ДНК и размножающимся в эукариотических клетках. Однако авторы работы предлагают рассматривать этот вирус не просто как сателлит, а как вирофаг (вирус вируса) по аналогии с бактериофагами (вирусами бактерий) . Разница в этих двух концепциях заключается в том, что вирусы-сателлиты полагаются на другой вирус и клетку-хозяина для своего размножения. Вирофаги же, как предполагается, воспроизводятся только за счёт репликативного аппарата вируса-хозяина, то есть являются паразитами исключительно другого вируса . Хотя строгое доказательство ещё предстоит получить, некоторые факты говорят в пользу того, что Спутник действительно является вирофагом. Например, в его геноме присутствуют регуляторные элементы, характерные для мимивируса и узнаваемые его транскрипционным аппаратом (последовательности, близкие к позднему промотору мимивируса, сигналы полиаденилирования). Кроме того, присутствие Спутника снижает продуктивность размножения мимивируса: лизис клетки-хозяина происходит позже, образуются дефектные вирионы .
На сегодняшний день был открыт второй вирофаг мимивируса — штамм CL .
Эволюция и происхождение мимивируса
Эволюция
Мимивирус и другие крупные ядерно-цитоплазматические ДНК-содержащие вирусы обладают рядом свойств, которые не вписываются в традиционные представления о вирусах: крупный размер вирионов, присутствие в вирионе одновременно двух типов нуклеиновых кислот, большой размер и сложность генома, присутствие нехарактерных для вирусов генов (гены белков, участвующих в трансляции, репарации ДНК и фолдинге белков ) и возможность выступать в качестве хозяина для другого вируса . Эти факты возродили интерес к вопросу о происхождении и эволюции вирусов.
Было высказано две принципиально разных гипотезы о происхождении сложного генома мимивируса. Согласно первой из них, мимивирус и другие крупные ядерно-цитоплазматические ДНК-содержащие вирусы произошли от более сложного предка (клетки или вируса) путём редукционной эволюции и принадлежат к четвёртому домену живого . По второй гипотезе, эволюция этих вирусов шла по пути усложнения и постепенного накопления генов, поступающих из геномов других организмов путём горизонтального переноса . Фактически обе гипотезы опираются на данные сравнительной геномики и протеомики , которые могут быть интерпретированы по-разному, учитывая тот факт, что они отражают события, возможно, происходившие сотни миллионов лет назад. Относительно быстрые темпы эволюции вирусов и интенсивный горизонтальный перенос генов осложняет анализ и затрудняет построение филогенетических деревьев . Собственно факты, с которыми согласно большинство исследователей, заключаются в том, что более половины генов (и мотивов укладки белков) мимивируса не имеют известных гомологов. Другие данные и их интерпретация продолжают оставаться темой горячих споров.
В геноме мимивируса были обнаружены необычные для вирусов гены, ортологи которых присутствуют у организмов всех трёх доменов (гены аминоацил-тРНК-синтетаз, субъединиц РНК- и ДНК-полимераз). Анализ этих и других генов мимивируса, для которых известны гомологи, позволил определить его относительное положение на филогенетическом дереве. Однако, в зависимости от алгоритма анализа, были получены очень разные результаты. По мнению одних исследователей, линия, ведущая к современному мимивирусу, обособилась примерно в то же время, что и эукариотическая, или даже раньше . Сходные результаты были получены и при сравнительном анализе типов белковых укладок . Другие же учёные настаивают на том, что эти гены были приобретены мимивирусом в результате горизонтального переноса от представителей эу- и прокариот и что нет никаких оснований выделять вирусы в четвёртый домен живого . Кроме того, большой размер генома мимивируса может быть объяснён особенностями занимаемой им экологической ниши, накладывающей меньшие ограничения на размеры генома. Существует мнение, что эти особенности позволили мимивирусу накопить большое количество копий гомологичных генов, которые возникали в результате дупликации генов и их дальнейшей независимой эволюции .
Происхождение
Вопрос о происхождении гигантских вирусов остаётся ещё более загадочным, чем вопрос их эволюции. Было высказано предположение, что представители группы крупных ядерно-цитоплазматических ДНК-содержащих вирусов ( поксвирусы , иридовирусы , , мимивирусы и др.) ведут своё начало от более сложных (возможно клеточных) форм, таких как современные микоплазмы и риккетсии . В пользу этой гипотезы говорит наличие в геноме крупных ДНК-содержащих вирусов большого количества «избыточных» генов, которые не являются строго необходимыми для размножения и функционально дублируют хозяйские. Сторонники этой точки зрения рассматривают, например, наличие у мимивируса и Megavirus chilensis неполного аппарата трансляции как признак того, что они произошли от свободноживущего или паразитического предка, у которого этот аппарат был полностью функционален . По мере открытия новых гигантских вирусов учёные надеются получить больше информации о возможном общем предке крупных ядерно-цитоплазматических ДНК-содержащих вирусов.
Альтернативная гипотеза вирусного эукариогенеза , напротив, предполагает возникновение ядра эукариотических клеток из крупных ДНК-содержащих вирусов, подобных мимивирусам . На разных этапах этого процесса новое примитивное ядро предположительно могло несколько раз возвращаться к существованию в форме гигантского вируса, что привело бы к формированию нескольких независимых групп вирусов.
Мимивирус и определение понятия «жизнь»
В 2000 году Международный комитет по таксономии вирусов официально объявил, что вирусы не относятся к живым организмам. Однако с открытием мимивируса эта идея была снова поставлена под сомнение . Хотя мимивирус, как и любой другой вирус, не имеет генов рибосомальных белков и использует рибосомы хозяина, он формирует вирусные фабрики , которые функционируют относительно независимо от клетки. Было высказано мнение, что именно вирусные фабрики, а не метаболически неактивные вирусные частицы, и следует рассматривать как вирус . Автор этой идеи полагает, что вирусная фабрика, осуществляющая репликацию ДНК, транскрипцию генов и синтез соответствующих белков с привлечением компонентов цитозоля, очень сильно напоминает клеточное ядро. С этой точки зрения, вирусные фабрики мимивируса кажутся гораздо ближе к живому, чем его вирион.
Тем не менее, многие учёные продолжают придерживаться более традиционного в последнее десятилетие мнения о том, что вирусы представляют собой неживые частицы . Возможно, более точно на этот вопрос можно будет ответить с открытием новых гигантских вирусов.
См. также
- Mycoplasma genitalium — одна из самых маленьких известных бактерий.
- Candidatus Pelagibacter ubique — бактерия, обладающая одним из самых маленьких геномов.
- Наноархеоты — самые маленькие из известных одиночных клеток, самый маленький геном среди прокариот.
Примечания
- ↑ Ghigo E., Kartenbeck J., Lien P., Pelkmans L., Capo C., Mege J. L., Raoult D. // PLoS Pathog. — 2008. — Т. 4 , вып. 6 . — С. e1000087 . — doi : . — . 14 марта 2023 года.
- (англ.) на сайте Международного комитета по таксономии вирусов (ICTV) .
- . bigenc.ru. Дата обращения: 15 марта 2020. 5 февраля 2020 года.
- . London: Telegraph UK. 2011-10-11. из оригинала 15 января 2014 . Дата обращения: 11 ноября 2011 .
- ↑ Arslan, D. et al. Distant mimivirus relative with a larger genome highlights the fundamental features of Megaviridae (англ.) // Proceedings of the National Academy of Sciences . — United States National Academy of Sciences , 2011. — Vol. 108 . — P. 17486—17491 . — doi : .
- Xiao C., Chipman P. R., Battisti A. J., Bowman V. D., Renesto P., Raoult D., Rossmann M. G. Cryo-electron microscopy of the giant Mimivirus // J Mol Biol. — 2005. — Т. 353 , вып. 3 . — С. 493—496 . — .
- ↑ Vincent A., La Scola B., Papazian L. Advances in Mimivirus pathogenicity // Intervirology. — 2010. — Т. 53 , вып. 5 . — С. 304—309 . — doi : . — .
- Xiao C., Rossmann M. G. // Curr Opin Virol. — 2011. — Т. 1 , вып. 2 . — С. 101—109 . — doi : . — . 24 июня 2022 года.
- Яковенко Л. В. // Биология : журнал. — 2008. — Т. 654 . 4 марта 2016 года.
- ↑ Claverie J. M., Abergel C., Ogata H. // Curr Top Microbiol Immunol. — 2009. — Т. 328 . — С. 89—121 . — . 17 июня 2018 года.
- Highfield, Roger, « от 3 января 2016 на Wayback Machine » Daily Telegraph , 15 October 2004.
- Wessner D. R. // Nature Education. — 2010. — Т. 3 , вып. 9 . — С. 61 . 1 ноября 2020 года.
- (англ.) . SIB Swiss Institute of Bioinformatics. Дата обращения: 3 февраля 2013. 10 февраля 2013 года.
- ↑ La Scola B., Audic S., Robert C., Jungang L., de Lamballerie X., Drancourt M., Birtles R., Claverie J. M., Raoult D. (англ.) // Science. — 2003. — Vol. 299 , iss. 5615 . — P. 2033 . — . 23 июля 2013 года.
- ↑ Colson P., de Lamballerie X., Fournous G., Raoult D. Reclassification of giant viruses composing a fourth domain of life in the new order Megavirales // Intervirology. — 2012. — Т. 55 , вып. 5 . — С. 321—332 . — doi : . — .
- ↑ Koonin E. V. // Curr Biol. — 2005. — Т. 15 , вып. 5 . — С. R167—169 . — . 24 сентября 2015 года.
- . Дата обращения: 27 декабря 2012. Архивировано из 5 января 2013 года.
- Van Etten J. L. Giant Viruses (англ.) // . — , 2011. — Vol. 99 , iss. 4 . — P. 304 . — doi : .
- ↑ Xiao C., Kuznetsov Y. G., Sun S., Hafenstein S. L., Kostyuchenko V. A., Chipman P. R., Suzan-Monti M., Raoult D., McPherson A., Rossmann M. G. // PLoS Biol. — 2009. — Т. 7 , вып. 4 . — С. e92 . — doi : . — . 5 июля 2020 года.
- ↑ Klose T., Kuznetsov Y. G., Xiao C., Sun S., McPherson A., Rossmann M. G. // Intervirology. — 2010. — Т. 53 , вып. 5 . — С. 268—273 . — doi : . — . 5 июня 2022 года.
- ↑ Zauberman N., Mutsafi Y., Halevy D. B., Shimoni E., Klein E., Xiao C., Sun S., Minsky A. // PLoS Biol. — 2008. — Т. 6 , вып. 5 . — С. e114 . — doi : . — . 5 июня 2022 года.
- ↑ Suzan-Monti M., La Scola B., Raoult D. Genomic and evolutionary aspects of Mimivirus // Virus Res. — 2006. — Т. 117 , вып. 1 . — С. 145—155 . — .
- ↑ Raoult D, Audic S, Robert C., Abergel C., Renesto P., Ogata H., La Scola B., Suzan M., Claverie J. M. (англ.) // Science. — 2004. — Vol. 306 , iss. 5700 . — P. 1344—1350 . — . 24 сентября 2015 года.
- . Дата обращения: 28 декабря 2012. 28 мая 2016 года.
- ↑ Legendre M., Arslan D., Abergel C., Claverie J. M. // Commun Integr Biol. — 2012. — Т. 5 , вып. 1 . — С. 102—106 . — . 24 сентября 2019 года.
- Claverie J. M., Ogata H., Audic S., Abergel C., Suhre K., Fournier P. E. Mimivirus and the emerging concept of "giant" virus // Virus Res. — 2006. — Т. 117 , вып. 1 . — С. 133—144 . — .
- ↑ Legendre M., Audic S., Poirot O., Hingamp P., Seltzer V., Byrne D., Lartigue A., Lescot M., Bernadac A., Poulain J., Abergel C., Claverie J. M. // Genome Res. — 2010. — Т. 20 , вып. 5 . — С. 664—674 . — doi : . — . 14 сентября 2022 года.
- ↑ Desnues C., Boyer M., Raoult D. Sputnik, a virophage infecting the viral domain of life // Adv Virus Res. — 2012. — Т. 82 . — С. 63—89 . — doi : . — .
- Prescott L. Microbiology. — Wm. C. Brown Publishers, 1993. — ISBN 0-697-01372-3 .
- ↑ Claverie J. M., Abergel C. Mimivirus and its virophage // Annu Rev Genet. — 2009. — Т. 43 . — С. 49—66 . — doi : . — .
- Piacente F., Marin M., Molinaro A., De Castro C., Seltzer V., Salis A., Damonte G., Bernardi C., Claverie J. M., Abergel C., Tonetti M. Giant DNA virus mimivirus encodes pathway for biosynthesis of unusual sugar 4-amino-4,6-dideoxy-D-glucose (Viosamine) // J Biol Chem. — 2012. — Т. 287 , вып. 5 . — С. 3009—3018 . — doi : . — .
- Colson P. and Raoult D. Lamarckian evolution of the giant Mimivirus in allopatric laboratory culture on amoebae // Front. Cell. Inf. Microbio.. — 2012. — Т. 91 , вып. 2 . — doi : .
- Ogata H., Raoult D., Claverie J. M. // Virol J. — 2005. — Т. 2 . — С. 8 . — . 1 мая 2023 года.
- Zauberman N., Mutsafi Y., Halevy D. B., Shimoni E., Klein E., Xiao C., Sun S., Minsky A. // PLoS Biol. — 2008. — Т. 6 , вып. 5 . — С. e114 . — doi : . 5 июня 2022 года.
- ↑ Mutsafi Y., Zauberman N., Sabanay I., Minsky A. // Proc Natl Acad Sci U S A. — 2010. — Т. 107 , вып. 13 . — С. 5978—5982 . — doi : . — . 2 августа 2022 года.
- . Membrana (12 апреля 2010). Дата обращения: 7 февраля 2013. Архивировано из 10 февраля 2013 года.
- La Scola B., Marrie T. J., Auffray J. P., Raoult D. // Emerg Infect Dis.. — 2005. — Т. 11 , вып. 3 . — С. 449—452 . — . 30 апреля 2020 года.
- Berger P., Papazian L., Drancourt M., La Scola B., Auffray J. P., Raoult D. // Emerg Infect Dis. — 2006. — Т. 12 , вып. 2 . — С. 248—255 . — . 29 апреля 2023 года.
- Raoult D., Renesto P., Brouqui P. // Ann Intern Med. 144(9):. — 2006. — Т. 144 , вып. 9 . — С. 702—703 . — . 4 марта 2016 года.
- Vanspauwen M. J. et al. // Respiratory Medicine. — 2012. — Т. 106 , вып. 12 . — С. 1690—1694 . — doi : . 6 апреля 2017 года.
- ↑ La Scola B., Desnues C., Pagnier I., Robert C., Barrassi L., Fournous G., Merchat M., Suzan-Monti M., Forterre P., Koonin E., Raoult D. The virophage as a unique parasite of the giant mimivirus (англ.) // Nature. — 2008. — Vol. 455 , iss. 7209 . — P. 100—104 . — doi : . — .
- Helen Pearson. (2008). Дата обращения: 2 февраля 2013. 10 февраля 2013 года.
- Александр Марков. (8 сентября 2008). Дата обращения: 2 февраля 2013. 10 февраля 2013 года.
- La Scola B., Campocasso A., N'Dong R., Fournous G., Barrassi L., Flaudrops C., Raoult D. Tentative characterization of new environmental giant viruses by MALDI-TOF mass spectrometry // Intervirology. — 2010. — Т. 53 , вып. 5 . — С. 344—353 . — doi : . — .
- Moreira D., López-García P. (англ.) // Science. — 2005. — Vol. 308 , iss. 5725 . — P. 1114 . — doi : . — .
- Nasir A., Kim K. M., Caetano-Anolles G. // BMC Evol Biol. — 2012. — Т. 12 . — С. 156 . — doi : . — . 4 октября 2013 года.
- Moreira D., Brochier-Armanet C. // BMC Evol Biol. — 2008. — Т. 8 , № 12 . — doi : . — . 24 сентября 2019 года.
- Williams T. A., Embley T. M., Heinz E. (англ.) // PLOS One . — Public Library of Science , 2011. — Vol. 6 , iss. 6 . — P. e21080 . — doi : . — . 17 октября 2022 года.
- ↑ Claverie J. M. // Genome Biol. — 2006. — Т. 7 , вып. 6 . — С. 110 . — . 16 августа 2019 года.
- Mary C. [10.1126/science.335.6072.1035 Giant Viruses Revive Old Questions About Viral Origins] (англ.) // Science. — 2012. — Vol. 335 , iss. 6072 . — P. 1035 . — .
- Luketa S. New views on the megaclassification of life // Protistology. — 2012. — Т. 7 , вып. 4 . — С. 218—237 .
- Moreira D., López-García P. Ten reasons to exclude viruses from the tree of life // Nat Rev Microbiol. — 2009. — Т. 7 , вып. 4 . — С. 306—311 . — doi : . — .
Литература
- Filée, Jonathan; Chandler, Michael. Unpacking the Baggage: Origin and Evolution of Giant Viruses // (неопр.) . — Springer Netherlands , 2012. — С. 203—216. — ISBN 978-94-007-4899-6 .
- Ghedin, Elodie, and Claverie, J. M., 2005, , Virology Journal 2 :62.
- Mutsafi Y., Fridmann-Sirkis Y., Milrot E., Hevroni L., Minsky A. (англ.) // Virology : journal. — 2014.
- Raoult D., Audic S., Robert C., Abergel C., Renesto P., Ogata H., La Scola B., Suzan M., Claverie J. M. The 1.2-megabase genome sequence of Mimivirus. Science. 2004 Nov 19;306(5700):1344-50.
- Yutin N., Wolf Y.I., Koonin EV. (англ.) // Virology : journal. — 2014.
Ссылки
- — изображения мимивируса
- Press Release: , Paris, 28 March, 2003.
- 2020-01-13
- 1

